Как связать аммиак
Обновлено: 25.04.2024
Связанным аммиаком условно называют соединения аммиака, не разлагаемые кислотой: ( NHJ SO4, NH4C1 и др. Определение этих соединений основано на взаимодействии их с формальдегидом; при реакции выделяются эквивалентные количества соответствующих кислот. [8]
Содержание связанного аммиака МН3 в паре не должно превышать 1000 мкг / кг, если потребители располагают аппаратами с поверхностями нагрева из медных сплавов. Если теплообменные аппараты с трубками из медных сплавов отсутствуют, то допустимая концентрация NH4 определяется особенностями условий работы потребителей пара. [9]
Количество связанного аммиака вычисляют как разность между общим содержанием аммиака в растворе и содержанием суммы свободного и полусвязанного аммиака. [11]
Количество связанного аммиака вычисляют как разность между общим содержанием аммиака в растворе и содержанием суммы свободного и полусвязанного аммиака. [12]
Выделение связанного аммиака осуществимо только при химической обработке воды растворами сильных оснований: гидроксида кальция или натрия. [13]
Для выделения связанного аммиака пользуются разложением солей щелочью более сильной, чем сам аммиак. [14]
Для выделения связанного аммиака воду, из которой предварительно удалег. [15]
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:

Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :

У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:

Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:

Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O

Атом азота находится в состоянии sp 3 -гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:

Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
| Например. Ф ормуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н-Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
 |  |
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
| Например. Ф ормуле С4Н11N соответствуют амины положения аминогруппы. |
Изомерия между типами аминов
| Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины. |
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Аммиак :NH3
| Поэтому амины и аммиак обладают свойствами оснований. |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |

1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:

1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):

При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:

1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |

2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:

3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:

| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:

4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:

Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.

| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:

- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |

Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.


Алюминий реагирует с щелочами с образованием гидроксокомплексов.

В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:

Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.


Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:

Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:

.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:

- Соли аминов вступают в обменные реакции в растворе:

Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
15 комментариев
Добавить ваш
Где получение аминов , там 2) Реакция Зинина слева написано R как радикал, а справа (после равно) уже метиламин, почему метиламин справа, а слева просто R? Разве Зинин не анилин получил этим способом?
Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония.
Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном?
Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Здравствуйте! Не показано взаимодействие аминов со спиртами.
Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования.
R3N + RCl = R4N(+)Cl(-)
По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр.
Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение.
спасибо, отличная идея!
для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть
На ЕГЭ пока оптической изомерии нет.
Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
что значит «дальнейшее»? у триметиламина — и так уже нет N-H связей, может вы имели в виду протонированный триметил-амин (скажем) солянокислый, что в форме соли он останется третичным амином например до момента щелочного депротонирования(высвобождения основания амина)
—
а что кстати, есть способ галоидным алкилом моноалкилирование первичного ароматического амина до вторичного осуществить, избежав образования третичного амина — диалкилированного уже
на этилировании уже проще, а вот метиллирование нейромедиаторов не удавалось остановить на стадии N,N-ДиМет.(например в ацетоне с карбонатом калия, или с DIPEA), выход третичного целевого амина всегда оказывался либо самым низким из продуктов реакции, либо просто очень низким(10% в сложной смеси аминов с преобладанием четвертичной соли триметиламмония метилиодида, а сейчас подумал — если при N-метилировании первичного ароматического амина метилиодидом, образуется гидроиодид N-метил…исх.пер.амина, он же даже во второе метиллирование уже не должен входить, усиленным основанием став (скажем адреналином, основнее норадреналина исходного как я понимаю за счет появившегося электроннодонороного метила) и так будет выведен из реакционной среды(например выпав осадком соли, не солватированной в неполярной РС)
получается в отсутствие основного катализа алкилирование первичных аминов ограничивается моно-алкилированием — не далее чем до вторичного амина? или на практике соли не так надёжны как в оптимистичных прогнозах теоретизирующего учащегося?
Связанным аммиаком условно называют соединения аммиака, не разлагаемые кислотой: ( NHJ SO4, NH4C1 и др. Определение этих соединений основано на взаимодействии их с формальдегидом; при реакции выделяются эквивалентные количества соответствующих кислот. [8]
Содержание связанного аммиака МН3 в паре не должно превышать 1000 мкг / кг, если потребители располагают аппаратами с поверхностями нагрева из медных сплавов. Если теплообменные аппараты с трубками из медных сплавов отсутствуют, то допустимая концентрация NH4 определяется особенностями условий работы потребителей пара. [9]
Количество связанного аммиака вычисляют как разность между общим содержанием аммиака в растворе и содержанием суммы свободного и полусвязанного аммиака. [11]
Количество связанного аммиака вычисляют как разность между общим содержанием аммиака в растворе и содержанием суммы свободного и полусвязанного аммиака. [12]
Выделение связанного аммиака осуществимо только при химической обработке воды растворами сильных оснований: гидроксида кальция или натрия. [13]
Для выделения связанного аммиака пользуются разложением солей щелочью более сильной, чем сам аммиак. [14]
Для выделения связанного аммиака воду, из которой предварительно удалег. [15]
1. Аспарагиновая и глутаминовая кислотыосуществляют первичное связывание NH3в момент его образования в клетке.Ферменты - аспарагинсинтетазаи глутаминсинтетаза- лигазы. Необходимым условием является участие АТФ.
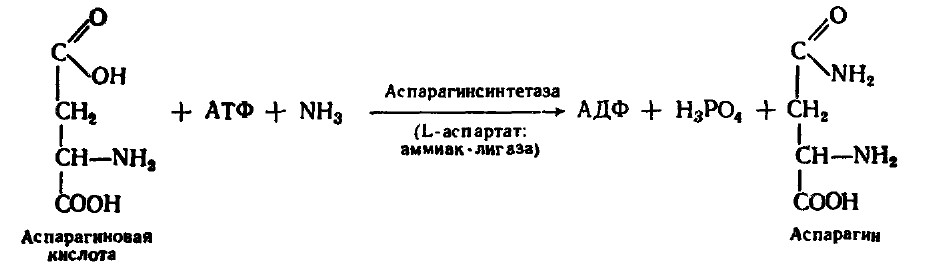
Синтез глутамина происходит особенно активно в мышцах, мозге, печени. Часть аммиака связывается с a-кетоглутаровой кислотой.

Глутамин и аспарагин выделяются с мочой в небольшом количестве. Предполагают, что они выполняют функцию переноса аммиака в нетоксичной форме.
Амидирование аспарагиновой и глутаминовой кислот может происходить и в том случае, если они находятся в составе белковой молекулы. Тем самым обеспечивается немедленное связывание аммиака везде, где он возникает в результате обмена веществ.
2. Мочевина— основной конечный продукт белкового обмена у многих животных. Азот мочевины составляет около 90 % всего выводимого азота. Синтез мочевины происходит в печени. Этот процесс происходит в несколько стадий, образующих орнитиновый цикл мочевинообразования Кребса.
1. Образование карбамоилфосфата из NH3, CO2 и АТФ при действии карбамоилфосфатсинтетазы.Макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака:
В организме человека открыты два пути синтеза карбамоилфосфата:
а) реакция под действием фермента аммиакзависимой карбамоилфосфатсинтетазы. Открыта в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины;
б) реакция, катализируемая глутаминзависимой карбамоилфосфатсинтетазой. Донором аминогруппы является глутамин. Открыта в цитозоле, используется преимущественно для синтеза пиримидиновых нуклеотидов.
2. Конденсация орнитина и карбамоилфосфата, фермент орнитинкарбамоилтрансфераза. 1 и 2 реакции протекают в митохондриях.
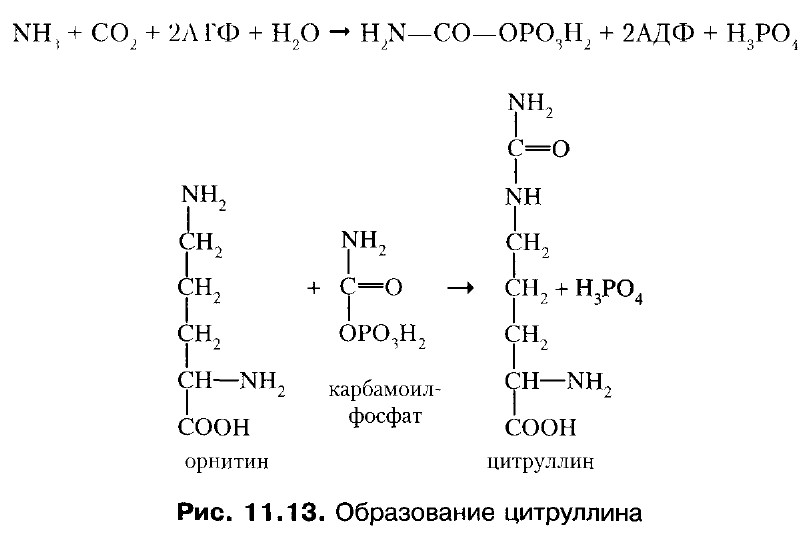
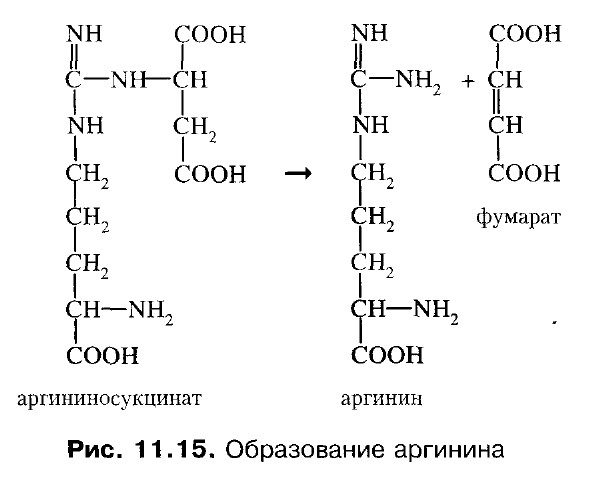
3. Цитруллин переходит в цитозоль и там реагирует с аспарагиновой кислотой, образуется аргининосукцинат. Фермент - аргининосукцинатсинтетаза.
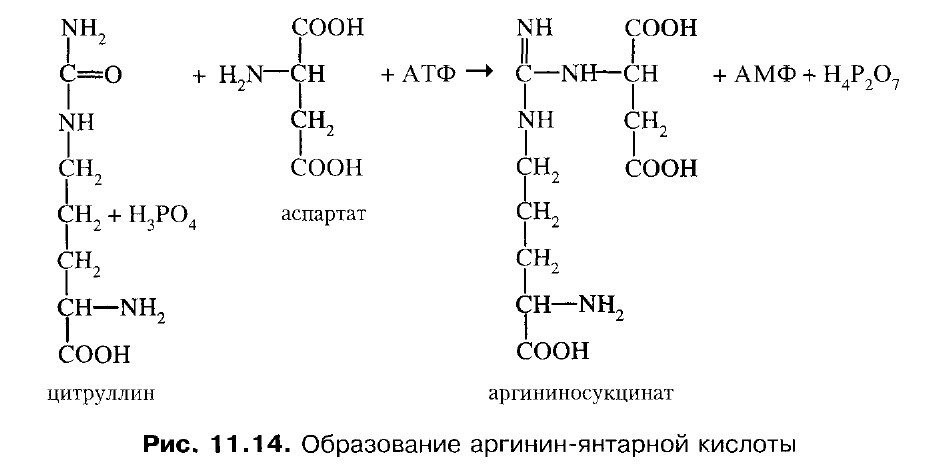
4. Аргининсукцинат распадается на аргинин и фумарат. Фермент – аргининосукцинатлиаза.
5. Гидролиз аргинина с образованием мочевины. Фермент - аргиназа.
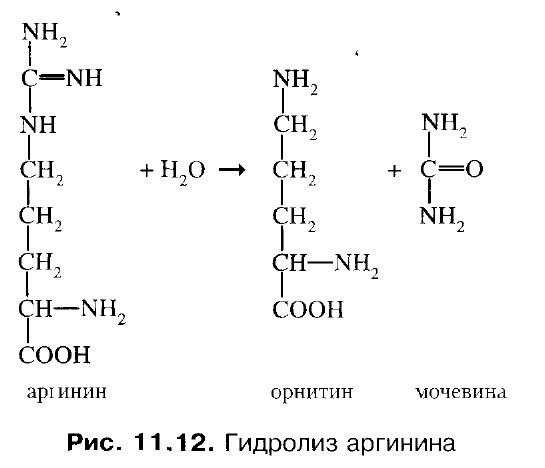
Образовавшийся орнитин вновь вовлекается в цикл образования мочевины. Фумарат превращается в аспартат:
фумарат ® пируват ® аспартат
На 1 моль синтезирующейся мочевины расходуется 3 моль АТФ.
Суммарное уравнение синтеза мочевины:

Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Орнитиновый цикл функционирует только в печени, а катаболизм аминокислот происходит и в других органах. Основными транспортными формами азота в печень являются глутамин, аланин и аммиак.
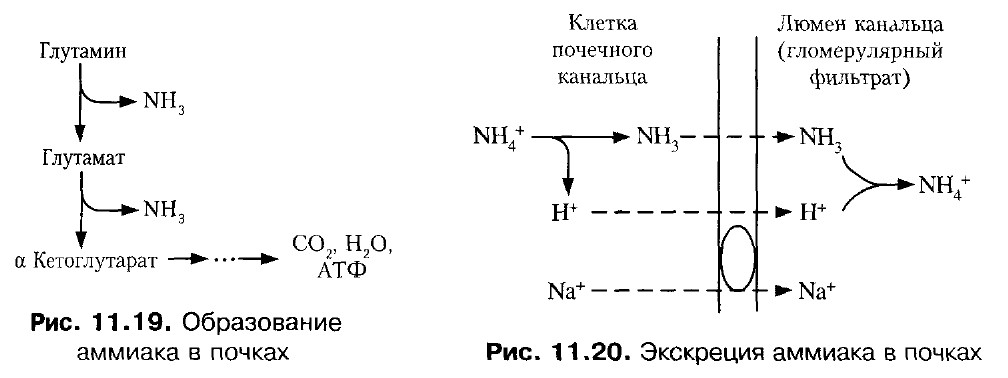
3. Некоторое количество аммиака выводится с мочой в виде аммонийных солей.Образование аммиака происходит в почках, главным образом из глутамина. Аммиак акцептирует протон, образуя аммонийную соль. Для иона аммония мембрана непроницаема. Образование и экскреция аммиака почками представляют собой механизм экскреции протонов (в составе NH4 + ). Экскреция аммиака с мочой в норме невелика — около 0,5 г в сутки. Она повышается при ацидозе (до 20 раз больше нормы). При алкалозе экскреция аммиака отсутствует.
4. Азот выводится в форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот.
5. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования a-кетокислот. Это главный путь новообразования аминокислот в организме человека. Эта реакция - обращение окислительного дезаминирования аминокислот. Возможно восстановительное аминирование любой кетокислоты. Но активно подвергаются восстановительному амиинированию a-кетоглутаровая кислота и пировиноградная кислота:

Остальные аминокислоты образуются в результате реакций трансаминирования аспарагиновой и глутаминовой кислот и аланина с соответствующими кетокислотами. Поэтому аланин, аспарагиновую и глутаминовую кислоты называют первичнымиаминокислотами, а все остальные - вторичными.
Читайте также: