Как связать дисперсность с размером частиц
Обновлено: 26.04.2024
Чистые вещества встретить в природном мире практически невозможно. В большинстве случаев они представляют собой гомогенную субстанцию, содержащую в своем составе частицы различных примесей. При этом не является обязательным наличие двух компонентов в смеси. Их количество может быть любым. Если одно вещество равномерно распределено в другом и не растворяется в нем, то такая система называется дисперсной системой.
Дисперсная система — гетерогенная (не однородная система), состоящая минимум из двух компонентов (фаз), один из которых (называемый дисперсной фазой) равномерно распределен по объему другого (называемого дисперсионной средой).
В составе типичной двухфазной системы выделяют:
- вещество в виде дисперсной фазы;
- вещество, под названием дисперсионная среда, в котором мелко распределено первое вещество.
В том случае, когда в системе несколько фаз, их можно отделить друг от друга. Для этого используют разные физические способы, к примеру, центрифугирование, сепарация. Типичные дисперсные системы относятся к коллоидным растворам (золям).
К дисперсным системам также относятся грубодисперсные системы, размеры частиц дисперсной фазы в которых составляет от 10 - 7 до 10 - 4 метра. Физические свойства дисперсных систем похожи на свойства растворов высокомолекулярных соединений.
Характеристика и особенности строения
Дисперсные системы являются гетерогенными смесями, в которых одно или более веществ распределены в другом. Каждый компонент системы обладает собственными свойствами. После извлечения его из системы его состояние будет соответствовать начальному.
Вещество, содержание которого в дисперсной системе выше, называют дисперсионной средой.
Второстепенное вещество является дисперсной фазой. В дисперсной системе не наблюдается взаимное взаимодействие между частицами. При этом имеется некая прослойка, которая их разделяет. Функцию этой прослойки выполняет вещество, образующее дисперсионную среду. В связи с этим системы называют гетерогенными или неоднородными.
В качестве примеров дисперсных систем можно привести:
- морскую воду;
- почву;
- большинство продуктов питания.
Перечисленные системы могут обладать любым агрегатным состоянием. В некоторых случаях допускается наличие одновременно нескольких фаз. Выделить их можно с использованием центрифуги или сепарированием.
Дисперсная фаза — вещество, равномерно распределенное в окружающей ее дисперсионной среде и не взаимодействующее с ней либо с другой дисперсной фазой при ее наличии в дисперсной системе.
Дисперсная фаза может состоять из аналогичных или неодинаковых по величине частиц, капель, либо пузырьков, которые расположены на некотором расстоянии друг от друга. По кинетическим свойствам (подвижность фазы), выделяют следующие типы дисперсных систем:
- дисперсная подвижная фаза;
- дисперсная неподвижная фаза с частицами, взаимно связанными и ограниченными в передвижении.
Свойства, которые характеризуют дисперсные системы, зависят от одного ключевого фактора. В результате их формирования образуется четкая межфазная граница.
В природе чаще можно встретить грубодисперсные системы. В этом случае фазу и среду различают при рассмотрении под микроскопом, а иногда и невооруженным глазом.
Рассмотренные системы характеризуются следующими показателями:
- степень (число) фаз;
- молекулярный вес;
- размеры частиц;
- агрегатное состояние;
- лиофобные/лиофильные.
В окружающей среде дисперсные системы встречаются повсеместно. Они могут быть природного и естественного происхождения. Существуют системы, выводимые в искусственном виде. В основе разных лекарственных составов, минеральных и химических удобрений, технологических процессов лежит явление дисперсности.
Классификация дисперсных систем
Дисперсные системы являются образованиями, в состав которых включено две фазы и более, почти не смешивающихся и не взаимодействующих друг с другом. В одном веществе, определяемом как дисперсионная среда, распределено другое вещество в виде дисперсной фазы. В зависимости от размеров частиц дисперсной фазы, системы классифицируют таким образом:
- молекулярно-ионные ( < 1 н м ) — истинные растворы;
- коллоидные ( 1 - 100 н м ), например, раствор крахмала в воде;
- грубодисперсные ( > 100 н м ), например вода с песком.
За основу максимально полной классификации дисперсных систем принимают агрегатное состояние среды и фазы. Благодаря сочетаниям трех типов агрегатного состояния, выделяют девять разновидностей двухфазных дисперсных систем.
Краткая запись таких систем имеет вид дроби с числителем, указывающим на дисперсную фазу, и знаменателем, определяющим дисперсионную среду. В качестве примера можно привести обозначение Г/Ж для системы «газ в жидкости».
Исходя из характера кинетических свойств фазы, двухфазные дисперсные системы разделяют на два класса:
- свободнодисперсные системы с подвижной дисперсной фазой;
- связнодисперсные системы с твердой дисперсионной средой, связанными друг с другом частицами дисперсной фазы, которые сохраняют неподвижное положение.
Рассмотренные дисперсные системы разделяют согласно степени дисперсности. В том случае, когда частицы дисперсной фазы в системе обладают идентичными размерами, такую систему называют монодисперсной. Если частицы фазы отличаются по размерам, то система является полидисперсной. Чаще в реальном мире можно встретить полидисперсные системы.
Существуют примеры дисперсных систем, которые отличаются большим количеством фаз. Такие комплексы называют сложными дисперсными системами. В качестве примера можно рассмотреть процесс вскипания жидкой дисперсионной среды с твердой дисперсной фазой, который приводит к образованию трехфазной системы «пар — капли — твердые частицы».
К сложным дисперсным системам можно отнести молоко. В веществе содержатся в большой концентрации, за исключением воды, жир, казеин, молочный сахар. Жир в молоке имеет вид эмульсии, в процессе хранения продукта он медленно поднимается наверх, образуются сливки.
Казеин является коллоидным раствором и не способен самостоятельно выделяться. С другой стороны, казеин достаточно просто выпадает в осадок в процессе подкисления молока, к примеру, с помощью уксуса. В результате образуется творог. Естественное выделение казеина можно наблюдать, когда молоко скисает. Молочный сахар в молоке представляет собой молекулярный раствор, который способен выделяться только в процессе испарения воды.
Классификация свободнодисперсных систем в зависимости от размеров частиц:
Ультрамикрогетерогенные системы по-другому называют коллоидными или золями. Исходя из того, какова природа дисперсионной среды, золи классифицируют следующим образом:
- твердые золи;
- аэрозоли (золи, обладающие газообразной дисперсионной средой);
- лиозоли (золи, характеризующиеся дисперсионной средой в жидком агрегатном состоянии).
Микрогетерогенные системы представлены следующими типами:
- суспензии;
- эмульсии;
- пены;
- порошки.
Среди наиболее распространенных грубодисперсных систем можно отметить комплексы «твердое тело — газ». Примером такой системы является песок.
Взвеси — являются дисперсионными системами, в которых фазы хорошо различимы визуально даже невооруженным глазом.
Ключевой характеристикой взвесей служит непрозрачность. При необходимости отделения среды и второстепенного вещества допустимо использовать стандартные фильтры или провести процедуру отстаивания. Классификация взвесей:
- Эмульсии. Данная система включает в себя среду и фазу, находящиеся в жидком агрегатном состоянии, не вступающие в химические реакции друг с другом и не растворяющиеся. Обычно эмульсии получают путем гомогенизации. К данному виду систем можно отнести большинство лекарственных средств или молоко.
- Суспензии. В этом случае среда обладает жидким агрегатным состоянием, а фаза представлена в виде твердой структуры. Суспензия образуется, когда в жидкость высыпают порошок. В результате формируется текучий состав по причине крайне мелкой фазы. Когда структура неподвижна, наблюдают выпадение осадка. В качестве примеров суспензий можно привести практически все строительные смеси.
- Аэрозоли. Данная система состоит из газообразного вещества, в котором распределена взвесь. Аэрозоли часто можно встретить в природном мире и быту. К примеру, аэрозолями являются грозовые или обычные облака, туманы и определенные виды осадков. В большинстве своем химические смеси, предназначенные для обработки растений в сельском хозяйстве, относятся к этому типу дисперсных систем.
Взвеси обладают большим значением для хозяйственной деятельности человека и природных процессов. В производстве активно применяют растворы. В окружающей среде распространены натуральные водные соединения, благодаря которым образуются почвы, и грунт насыщается питательными веществами. Взвеси являются непосредственными участниками жизнедеятельности всех живых существ.
Коллоидные системы важны для биологии и жизни человека. Биологические жидкости организма состоят из веществ, которые находятся в коллоидном состоянии. Такие биологические объекты, как клетки мышц и нервов, рассматривают в качестве коллоидных растворов. Дисперсионная среда крови представлена в виде плазмы, то есть водного раствора неорганических солей и белков.
Коллоидные системы отличаются от взвесей тем, что их разделение возможно лишь при наличии современного оборудования и специальных препаратов. Визуально данные комплексы можно идентифицировать, как однородные субстанции. По этой причине затруднено определение дисперсности коллоидных систем. Выделяют следующие типы:
- Коллоидные растворы или золи. Эти системы объединены общим свойством прозрачности. В процессе определения дисперсности систем сквозь жидкость пропускают направленный пучок света. В результате появляется «дорожка». Явление объясняется отражением лучей фазными частицами (конус Тиндаля). К данным систем относят, к примеру, крахмал, белки, клей, лимфу и кровь. Для отделения среды от распределенного в ней вещества используют профессиональное оборудование. Если продолжительное время отстаивать растворы или золи, в итоге не образуется осадок.
- Гели или студни. В качестве примеров можно представить разные медицинские препараты, кондитерские кремы, желатин. Большинство данных систем на начальных стадиях производства имеют вид золей. Когда температура снижается, осуществляется переход в новое состояние. Определенные системы трансформируются в эластичные твердые вещества, например, пластилин или глину для лепки.
Коллоидные системы имеют большое значение для химии. Данные системы получают с помощью смешивания в специальной технике. Производство подобных структур способствует созданию множества медицинских средств, удобрений и других полезных материалов.
Типы растворов высокомолекулярных веществ:
Принадлежность к той или иной группе определяется качествами высокомолекулярного вещества такими, как:
- тип фазы;
- среда;
- температура;
- иные условия.
Свойства высокомолекулярных веществ:
- Низкая скорость смешивания (медленная диффузия).
- На первом этапе вещества набухают, а далее смешиваются.
- Полимерные и истинные растворы обладают рядом значительных отличий.
- Законы, которые справедливы в случае с одними системами (Рауля, Вант-Гоффа), не характерны для других.
- По всей образованной субстанции свойства могут различаться по причине неодинакового направления и/или размеров молекул.
- Вещества обладают повышенной вязкостью.
Самопроизвольное образование характерно для определенных полимерных растворов. В том случае, когда набухание выполняется неорганическим методом, дисперсная система прекращает свое существование. Это связано с полным растворением фазы в среде, что сопровождается химической реакцией. Если метод набухания органический, то можно наблюдать получение студня.
Отдельно выделяют связнодисперсные системы, к которым относят пористые материалы. В зависимости от размеров пор, данные вещества классифицируют таким образом (классификация М.М. Дубинина):
Согласно рекомендациям ИЮПАК, микропористыми называют пористые материалы с размерами пор до 2 нм, мезопористыми — от 2 до 50 нм, макропористыми — свыше 50 нм.
Классификация пористых материалов в зависимости от структуры:
- Корпускулярные тела, сформированные за счет срастания определенных структурных компонентов, имеющих чаще всего разные формы и размеры. Срастающиеся элементы могут быть не пористыми или обладать первичной пористостью, к примеру, пористая керамика, бумага, ткань. Роль пор играют пространства между компонентами структуры.
- Губчатые тела являются результатом топохимических реакций, выщелачивания определенных составляющих твердых гетерогенных систем, пиролитического разложения твердых веществ, поверхностной и объемной эрозии. Поры губчатых тел образуют сеть из каналов и полостей разнообразных форм и неодинакового переменного сечения.
В зависимости от геометрических признаков пористые структуры классифицируют следующим образом:
- регулярные, с правильным чередованием отдельных пор или полостей и соединяющих их каналов;
- стохастические, в которых ориентация, форма, размеры, взаимное расположение и взаимосвязи пор определены случайным образом.
Большинство пористых материалов обладают стохастической структурой.
- открытые поры сообщаются с поверхностью, что обеспечивает фильтрацию жидких или газообразных сред;
- тупиковые поры аналогично сообщаются с поверхностью объекта, но не влияют на проницаемость материала;
- закрытые поры.
В качестве примера твердых гетерогенных систем можно привести композитные материалы. Композиты являются искусственно полученными сплошными, но неоднородными структурами. В состав данных материалов может быть включено два компонента и более. Отличительной особенностью являются четкие границы раздела между составными элементами. Кроме слоистых, большинство компонентов композитных материалов подразделяются на следующие группы:
- матрица, обеспечивающая совместную работу армирующих элементов;
- армирующие компоненты, отвечающие за механические параметры материала.
Старейшими композитами являются саман, железобетон, булат, папье-маше. В современной промышленности активно практикуют применение фиброармированных пластиков, стеклопластика, металлокерамики.
Движение дисперсных систем
Движение дисперсных систем изучает наука механика многофазных сред. К примеру, для исследования в области пристеночных течений системы «газ — жидкие капли» используют математическое моделирование. На основе полученных данных разрабатывают технологии нанесения разнообразных покрытий и оптимизируют различное теплоэнергетическое оборудование — такое, как паротурбинные установки и теплообменники.
С другой стороны, наличие разных типов структуры пристеночных течений многофазных сред делает необходимым учет различных факторов — таких, как инерционность капель, формирование жидкой пленки, фазовые переходы. Данные задачи решают путем конструирования особых математических моделей многофазных сред, разработки которых активно ведутся в настоящее время.
Возможности для изучения аналитическим методом нестационарных газодинамических течений многофазных дисперсных сред с несущей фазой в виде газа, которая включает в себя мелкие частицы твердого или жидкого вещества, значительно ограничены. В этом случае предпочтение отдается способам вычислительной механики.
Актуальны исследования подобных течений, когда существуют интенсивные фазовые переходы. В качестве примера можно привести:
- анализ аварийных ситуаций в охладительных системах, которыми оснащены атомные электростанции;
- изучение вулканической активности;
- разработка технологических приложений для оптимизации устройств, предназначенных для создания высокоскоростных многофазных струй.
При рассмотрении свободнодисперсных систем, среда в которых представлена в газообразном или жидком агрегатном состоянии — например, аэрозолей, коллоидных растворов, газовых эмульсий, мицеллярных растворов поверхностно-активных веществ, — можно сделать вывод о подвижности дисперсных частиц. Они могут совершать вращательные движения, колебания с неодинаковой амплитудой.
Подвижность дисперсных частиц, особенно высокодисперсных и ультрадисперсных, является фундаментальным свойством свободнодисперсных систем. Дисперсные частицы движутся за счет различных факторов. Процесс определяется размером частиц. Для высокодисперсных частиц характерны малые размеры, что способствует их активному участию в броуновском движении. Такое явление рассматривают в качестве проявления молекулярно-кинетических свойств дисперсных систем.
Другим молекулярно-кинетическим свойством является диффузия дисперсных частиц, в процессе которой они перемещаются по причине неодинаковой концентрации в разных участках дисперсной системы. Благодаря диффузии, концентрация частиц постепенно становится однородной. Согласно второму началу термодинамики, при диффузии можно наблюдать увеличение энтропии дисперсной системы.
Дисперсные частицы, обладающие большими размерами (в том числе, твердые частицы, капли, газовые пузыри), почти не принимают участия в броуновском движении. Таким образом, для грубодисперсных систем не характерны молекулярно-кинетические свойства. Данный признак позволяет квалифицировать системы на высокодисперсные и грубодисперсные.
Основная причина движения крупных дисперсных частиц заключается в разнице между плотностями дисперсной фазы и дисперсионной среды. В том случае, когда плотность дисперсной фазы больше, частицы медленно выпадают в осадок в результате воздействия силы тяжести. Такое явление называют седиментацией. Частицы, которые обладают меньшим весом, всплывают на поверхность. Тогда процесс называют обратной седиментацией.
На движение дисперсных частиц оказывают влияния другие внешние силы. Большое значение для коллоидной химии имеет движение заряженных частиц дисперсной фазы в электрическом поле. Такой процесс носит название электрофорез.
В отдельную группу выделяют перемещения дисперсных частиц, происходящие совместно с движущейся дисперсионной средой. Данные потоки являются двухфазными и обладают рядом существенных отличий от однофазных потоков газов или жидкостей.
К примеру, наличие в жидком веществе малого количества дисперсных частиц способствует увеличению степени вязкости дисперсной системы в сравнении с аналогичными показателями дисперсионной среды.

Данное издание создано в помощь студентам вузов, которые хотят быстро подготовиться к экзаменам и сдать сессию без проблем. Пособие составлено с учетом Государственного образовательного стандарта.
Оглавление
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
Основная характеристика дисперсных систем — размеры частиц, или дисперсность. Дисперсные системы делят на грубодисперсные (низкодисперсные) и тонкодисперсные (высокодисперсные), или коллоидные системы (коллоиды). В грубодисперсных системах частицы имеют размер от 10 –4 см и выше, в коллоидных — от 10 –4 до 10 –5 — 10 –7 см. Дисперсность определяется по трем измерениям тела, либо характеризуется величиной, обратной минимальному размеру и названной дисперсностью, либо через удельную площадь поверхности Sуд (отношение межфазной поверхности к объему тела). Количественной характеристикой дисперсности (раздробленности) вещества является степень дисперсности (степень раздробленности D) — величина, обратная размеру дисперсных частиц а: D = 1/a, где а равно диаметру сферических или волокнистых частиц, или длине ребра кубических частиц, или толщине пленок. Все частицы дисперсной фазы имеют одинаковые размеры — монодисперсная система. Частицы дисперсной фазы неодинакового размера — полидисперсная система. Соотношение между поверхностью и объемом характеризует удельная поверхность:
Sуд = S / V.
Для частиц сферической формы она равна:
Sуд = 4 πr 2 / (4 / 3 πr) = 3 / r = 6 / d.
Для частиц кубической формы —
Sуд = 6l 2 / l 3 = 6 / l,
где r — радиус шара; d — его диаметр; l — длина ребра куба.
Дисперсность D связана с удельной поверхностью Sуд:
Sуд = S / V = k / d = kD,
где V — объем дисперсной фазы, мл.
Для сферических частиц уравнение принимает вид:

k — коэффициент формы частиц; d — диаметр частицы, м 2 .
Формула для расчета удельной поверхности (Sуд) системы с шарообразными частицами:

где n — число частиц, м 3 ; S0 — поверхность каждой частицы.

где n1 — число частиц, кг; r — плотность вещества, г/см 3 .
Корреляционная спектроскопия рассеянного света: в определенном оптическом объеме V0, подсчитывают число частиц n. Зная концентрацию частиц С и n, находят объем частицы : = С / (vd),
В основу наиболее простой классификации дисперсных систем положены размеры частиц дисперсной фазы, т.е. дисперсность. Согласно этой классификации все дисперсные системы условно подразделяют:
· На грубодисперсные (размер частиц > 10 –5 м) – частицы видны невооруженным глазом, оседают под действием силы тяжести, не проходят через бумажные фильтры;
· среднедисперсные или микрогетерогенные (размер частиц
10 –5 –10 –7 м) – частицы видны в обычный микроскоп, не проходят через бумажные фильтры;
· высокодисперсные или коллоидные (размер частиц 10 –7 –10 –9 м ) – частицы проходят через бумажные и стеклянные фильтры, но не проходят через ультрафильтры; невидимы в обычный микроскоп, но видимы в ультра- и электронный микроскоп.
1.2.2. Классификация по агрегатному состоянию
дисперсной фазы и дисперсионной среды
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсной фазы (ДФ) и дисперсионной среды (ДС). Сочетание трех агрегатных состояний дисперсной фазы и дисперсионной среды позволяет выделить девять типов дисперсных систем. Для краткости их обозначают дробью, в числителе которой указывается агрегатное состояние дисперсной фазы, а в знаменателе – дисперсионной среды: ДФ/ДС.
Классификация дисперсных систем по агрегатному состоянию
| Дисперсная фаза | Дисперсионная среда | Обозначение | Примеры |
| Твердая | Газообразная | Т/Г | Пыль, дым, смог |
| Жидкая | Т/Ж | Золи (золи металлов в воде, взвеси в природных водах), суспензии | |
| Твердая | Т/Т | Твердые коллоидные растворы (бетон, сплавы, цветные стекла, минералы, самоцветы) | |
| Жидкая | Газообразная | Ж/Г | Аэрозоли (туман, облака) |
| Жидкая | Ж/Ж | Эмульсии (молоко, сырая нефть, крема) | |
| Твердая | Ж/Т | Жидкость в пористых телах (адсорбенты, почвы) | |
| Газообразная | Газообразная | Г/Г | Системы с флуктуациями плотности (атмосфера Земли) |
| Жидкая | Г/Ж | Газовые эмульсии, пены | |
| Твердая | Г/Т | Пористые и капиллярные тела (адсорбенты, катализаторы, пемза, активированный уголь) |
В общем случае высокодисперсные системы называют золями (гидрозолями, органозолями, лиозолями, аэрозолями – по характеру дисперсионной среды), грубодисперсные системы типа Т/Ж называют суспензиями, типа Ж/Ж – эмульсиями.
1.2.3. Классификация по силе межфазного взаимодействия
дисперсной фазы и дисперсионной среды
Эта классификация применима только для систем с жидкой дисперсионной средой. В зависимости от характера взаимодействия дисперсной фазы с дисперсионной средой различают лиофильные и лиофобные дисперсные системы.
Существуют различные способы классификации дисперсных систем. В наиболее широком плане дисперсные системы классифицируют по следующим признакам:
1) размеру частиц дисперсной фазы,
2) агрегатному состоянию как частиц дисперсной фазы, так и дисперсионной среды;
3) форме частиц дисперсной фазы,
4) интенсивности межфазового взаимодействия,
5) наличию структурообразования между частицами дисперсной фазы.
1. В зависимости от размера частиц дисперсной фазы дисперсные системы обычно подразделяют на три типа: истинные растворы, коллоидные и грубодисперные системы. Для большей наглядности представим сказанное в виде таблицы 10.1:
| Тип системы | Размер частиц | Название | Состояние системы |
| Молекулярно- и ионно-дисперсные | < 10 Å (10 -9 м) | истинные растворы | гомогенные |
| Высокодисперсные | 10 – 1000 Å | коллоидные растворы | Ультра и микрогетерогенные |
| Грубодисперсные | >1000 Å | взвеси | гетерогенные |
Истинные растворы представляют собой однородные смеси, в которых частицами дисперсной фазы являются отдельные молекулы, атомы или ионы с размером не более 10 -9 м (1нм). Такие частицы не имеют фазовой границы или собственной поверхности раздела. Образуемые ими дисперсные системы гомогенны.
В случае высоко- и грубодисперсных систем частицы дисперсной фазы имеют более крупные размеры (10 – 100 нм), чем отдельные атомы, и обладают собственной фазовой поверхностью. Такие системы гетерогенны. При этом высокодисперсные системы обладают качественными отличиями от грубодисперсных систем и рассматриваются в отдельной теме «Коллоидные растворы».
2. В зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы классификацию дисперсных систем также нагляднее представить в виде таблицы (см. табл.10.2):
Агрегатное состояние будем обозначать буквами: Т – твёрдое (кристаллическое), Ж – жидкость, Г – газ. Дисперсионную среду – индексом 1, а дисперсную фазу – индексом 2.
| Фазовое состояние системы | Условное обозначение и примеры | Тип дисперсной системы | ||
| Газообраз-ное | Г1 – Г2 * | Г1 – Ж2 туман,облака | Г1 – Т2 дым, пыль | Аэрозоли |
| Жидкое | Ж1 – Г2 жидкие пены | Ж1 – Ж2 эмульсии | Ж1 – Т2 суспензии, взвеси | Лиозоли |
| Твёрдое | Т1 – Г2 твердые пены | Т1 – Ж2 жемчуг, опал | Т1 – Т2 сплавы | Солио-золи |
В нормальных условиях гомогенны, гетерогенность возможна только при очень низких температурах или высоких давлениях.
3. Форма частиц дисперсной фазы (или топология) может быть разнообразной. Наиболее удобный способ классификации связан с делением на
а) линейные частицы, вытянутые в одном измерении;
б) плоские или пластинчатые, имеющие два измерения; и
в) объёмные, когда частицы имеют все три пространственные измерения примерно в равной степени.
4. В зависимости от интенсивности межфазового взаимодействия выделяют два типа систем:
а) с интенсивным межфазовым взаимодействием (например, когда поверхность твёрдых частиц смачивается жидкой дисперсионной средой - лиофильность), и
б) с его отсутствием (например, когда поверхность твёрдых частиц не смачивается жидкой дисперсионной средой – лиофобность).
5. В зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы (структурообразования) в дисперсных системах различают два случая.
Первый, когда частицы дисперсной фазы распределены в дисперсионной среде без непосредственного контакта друг с другом – свободнодисперсные системы. Высокодисперсные системы с жидкой дисперсионной средой, обладающие текучестью, называют коллоидными растворамиили золями. Исторически первыми название «золь» получили ультрамикрогетерогенные системы с частицами размером 1–100 нм, диспергированными в жидкой среде.
Второй, когда частицы дисперсной фазы контактируют друг с другом с образованием тех или иных пространственных структур – связаннодисперсные системы. Состояние коллоидных растворов, утративших текучесть в результате возникновения в них внутренних структур, называют «гель» (от латинского gelate – замерзать) или студнями. Процесс структурообразования называют гелеобразованием (желатинированием, желатинизацией или студнеобразованием).

Свободная поверхностная энергия и устойчивость
дисперсных систем.
Для высокодисперсных систем характерно наличие значительной удельной поверхности дисперсной фазы (Sуд) и интенсивного физико-химического взаимодействия между дисперсной фазой и дисперсионной средой на границе раздела фаз.
Свойства вещества на межфазовой поверхности отличаются от свойств внутри фазы. Внутри фазы молекулы или другие структурные единицы вещества равномерно окружены такими же частицами и их взаимодействие между собой взаимно скомпенсировано во всех направлениях, за счёт этого каждая молекула достигает определённого минимума энергии и находится как бы на дне «потенциальной ямы». На поверхности же фазы окружение частично меняется. Со стороны окружающей среды это взаимодействие не скомпенсировано, так как там присутствуют иные вещества или иного агрегатного состояния. Это приводит к появлению так называемой поверхностной энергии, величину которой можно представить как произведение её удельного значения (σ) на суммарную поверхность раздела (S). Наличие этого избытка поверхностной энергии (σ•S) является характерной особенностью высокодисперсных систем и определяет ряд присущих им свойств, таких как электрические, поверхностные явления и др.
Из термодинамики известно, что все самопроизвольные процессы протекают в направлении уменьшения свободной энергии. Аналогично происходят процессы и на поверхности раздела фаз (самопроизвольно в стремлении к уменьшению запаса свободной поверхностной энергии). Поэтому в таких системах σ•S→min. Вследствие этого высокодисперсные системы принципиально являются термодинамически неустойчивыми. В чём проявляется их неустойчивость? Возможны два случая.
Первый имеет место при σ=сonst, т.е. когда природа веществ на границе раздела фаз не изменяется. В этом случае стремление к уменьшению свободной поверхностной энергии реализуется за счёт уменьшения суммарной поверхности раздела S→min. Это происходит путём слияния, слипания и укрупнения дисперсных частиц с уменьшением степени их дисперсности, что приводит в итоге к разрушению дисперсной системы. Поэтому способность дисперсных систем сохранять присущую им степень дисперсности называется агрегативной устойчивостью. В этой связи агрегативно устойчивы грубодисперсные и молекулярные системы. У первых поверхность раздела фаз очень мала (S→0), а у вторых отсутствует (S=0). Агрегативно неустойчивы высокодисперсные системы, у которых S может быть очень большой и достигать десятков или даже сотен квадратных метров на один грамм дисперсной фазы. Их самопроизвольное разрушение называется коагуляцией.
Второй путь снижения свободной поверхностной энергии дисперсных систем имеет место при сохранении постоянной степени дисперсности S=сonst. В этом случае происходит изменение природы веществ на поверхности раздела фаз за счёт поглощения (сорбции) из окружающей среды тех веществ, сорбция которых сопровождается более ощутимым уменьшением удельной поверхностной энергии σ→min. В силу указанных выше причин эта способность также проявляется наиболее заметно у высокодисперсных систем и носит название поверхностных явлений.
Кроме этого, разрушение дисперсных систем возможно и без изменения степени дисперсности, например, в результате осаждения из дисперсионной среды относительно более тяжёлых частиц. Способность дисперсных систем сохранять одинаковой концентрацию дисперсных частиц по всему объёму называется кинетической устойчивостью. В этом плане наиболее устойчивы истинные растворы, наименее – грубодисперсные системы (взвеси). Высокодисперсные системы занимают промежуточное положение, а при правильном хранении могут существовать длительное время. Известно, что коллоидный раствор частиц золота, приготовленный ещё М.Фарадеем, не потерял устойчивости до нашего времени.
Таким образом, высокодисперсное состояние вещества – это качественно особая форма его существования, с присущими ей специфическими свойствами и отличиями. Закономерности её изучает коллоидная химия. Термин коллоиды был введен в 1861 г. английским химиком Томасом Грэмом, изучавшим поведение белковых растворов, и означает в переводе с греческого клееподобные.
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
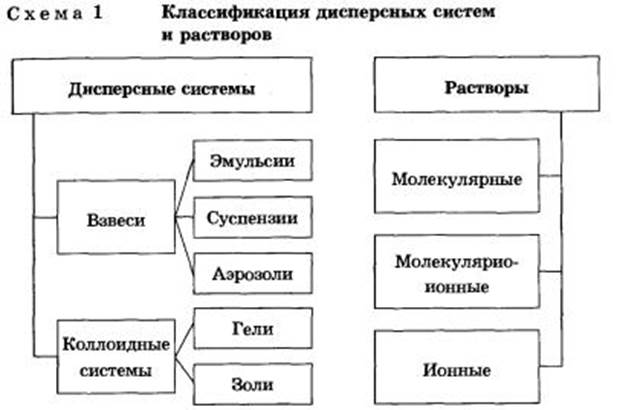
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
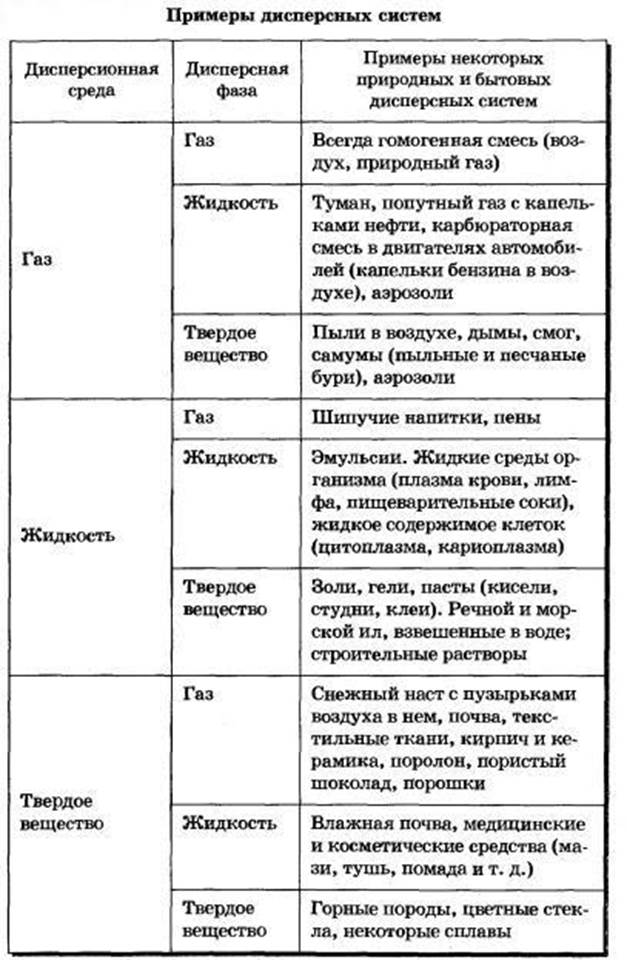
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
По агрегатному состоянию дисперсной фазы и дисперсионной среды
Для удобства, дисперсные системы принято условно обозначать через дробь, где в числителе указывают агрегатное состояние дисперсной фазы, а в числителе – дисперсионной среды:
| Дисперсная фаза | Дисперсионная среда | Условное обозначение | Название системы |
| Газ | Газ | Г/Г | Дисперсные системы не образуются |
| Газ | Жидкость | Г/Ж | Газовые эмульсии |
| Газ | Твердое вещество | Г/Т | Пористые тела |
| Жидкость | Газ | Ж/Г | Аэрозоли |
| Жидкость | Жидкость | Ж/Ж | Эмульсии |
| Жидкость | Твердое вещество | Ж/Т | Капиллярные системы |
| Твердое вещество | Газ | Т/Г | Порошки, пыли |
| Твердое вещество | Жидкость | Т/Ж | Суспензии и золи |
| Твердое вещество | Твердое вещество | Т/Т | Твердые гетерогенные системы |
Классификация дисперсных систем и растворов
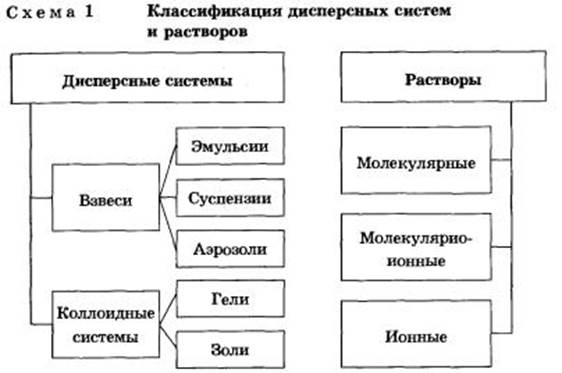
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на:
1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
2) суспензии (среда — жидкость, а фаза — нерастворимое в ней твердое вещество). Это строительные растворы (например, «известковое молоко» для побелки), взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде — планктон, которым питаются гиганты-киты, и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний — взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи — взвесь в воздухе капелек воды, дым — мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига — клинкера. Аналогичные вредные аэрозоли — пыли — имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли.
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.

Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.). Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия («растворимого стекла») с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (Ш) в горячей воде. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся «светящейся дорожке» — конусу при пропускании через них луча света.
Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Но при определенных условиях может происходить процесс коагуляции.
Коагуляция— явление слипания коллоидных частиц и выпадения их в осадок — наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
2. Гели, или студни, представляющие собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, желе, мармелад, торт «Птичье молоко») и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т. д. Историю развития жизни на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается — из них выделяется вода. Это явление называют синерезисом.
Растворы
Раствором называют гомогенную систему, состоящую из двух и более веществ.
Растворы всегда однофазны, то есть представляют собой однородный газ, жидкость или твердое вещество. Это связано с тем, что одно из веществ распределено в массе другого в виде молекул, атомов или ионов (размер частиц менее 1 нм).
Растворы называют истинными, если требуется подчеркнуть их отличие от коллоидных растворов.
Растворителем считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Например, вода в водных растворах поваренной соли, сахара, углекислого газа. Если же раствор образовался при смешении газа с газом, жидкости с жидкостью и твердого вещества с твердым, растворителем считают тот компонент, которого больше в растворе. Так, воздух — это раствор кислорода, благородных газов, углекислого газа в азоте (растворитель). Столовый уксус, в котором содержится от 5 до 9% уксусной кислоты, представляет собой раствор этой кислоты в воде (растворитель — вода). Но в уксусной эссенции роль растворителя играет уксусная кислота, так как ее массовая доля составляет 70— 80%, следовательно, это раствор воды в уксусной кислоте.
При кристаллизации жидкого сплава серебра и золота можно получить твердые растворы разного состава.
Растворы подразделяют на:
• молекулярные — это водные растворы неэлектролитов — органических веществ (спирта, глюкозы, сахарозы и т. д.);
• молекулярно-ионные — это растворы слабых электролитов (азотистой, сероводородной кислот и др.);
• ионные — это растворы сильных электролитов (щелочей, солей, кислот — NaOH, K2S04, HN03, НС1О4).
Раньше существовали две точки зрения на природу растворения и растворов: физическая и химическая. Согласно первой растворы рассматривали как механические смеси, согласно второй — как нестойкие химические соединения частиц растворенного вещества с водой или другим растворителем. Последняя теория была высказана в 1887 г. Д. И. Менделеевым, который посвятил исследованию растворов более 40 лет. Современная химия рассматривает растворение как физико-химический процесс, а растворы как физико-химические системы.
Более точное определение раствора таково:
Раствор — гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Поведение и свойства растворов электролитов, как вы хорошо знаете, объясняет другая важнейшая теория химии — теория электролитической диссоциации, разработанная С. Аррениусом, развитая и дополненная учениками Д. И. Менделеева, и в первую очередь И. А. Каблуковым.
Читайте также: