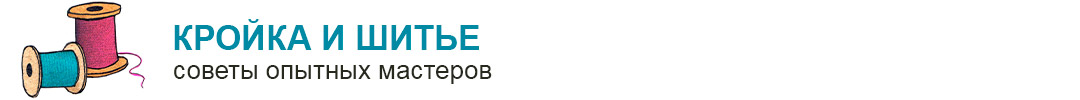Механизм микробного антагонизма можно связать
Обновлено: 22.04.2024
С явлением антагонизма в мире микробов было связано открытие антибиотиков.
Антагонизм широко распространен в природных микробных сообществах, состоящих из бактерий, грибов, актиномицетов. дрожжей, водорослей, простейших и других микроорганизмов. Широкое понятие антагонизма включает и такие формы взаимоотношений, как конкуренция, хищничество, паразитизм. Нас в данном случае интересует антагонизм в узком смысле, т. е. антагонизм, обусловленный образованием антимикробных веществ и, в частности, антибиотиков. Взаимоотношения, обусловленные продукцией любых антимикробных веществ, можно назвать активным или прямым антагонизмом. В отличие от него существует пассивный, или косвенный, антагонизм, при котором подавление одних микроорганизмов происходит за счет изменения другими микробами условий окружающей среды в неблагоприятную для развития сторону. Антагонизм может быть односторонним (микроорганизм подавляет развитие своего конкурента, не реагируя на воздействие соперника) и двусторонним (происходит взаимное угнетение микроорганизмов в сообществе). Существует еще понятие направленного (насильственного), или вынужденного, антагонизма. При этих взаимоотношениях наблюдается образование антимикробных веществ (вероятно, различной природы, обладающих разным механизмом действия) только при совместном выращивании двух различных микроорганизмов, которые в условиях изолированного культивирования этих веществ не образуют. Антагонизм между микроорганизмами можно наблюдать и в лабораторных условиях. Активность продуцентов антибиотиков обычно выражают массой антибиотика, содержащейся в единице объема питательной среды, в которой выращивали продуцент.
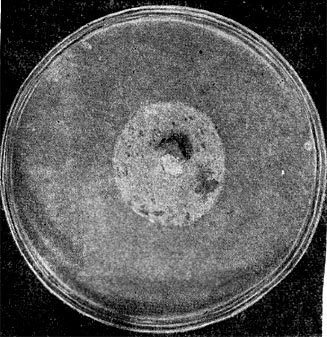
Рис. 193. Синергизм у микробов. Вокруг агарового блока с культурой актиномпцета видна зона стимуляции роста плесневого гриба.
Термин «антибиотики», или «антибиотические вещества», предложенный в 1942 г. Вакс-маном, первоначально обозначал химические соединения, образуемые микроорганизмами, которые обладают способностью подавлять рост и даже разрушать бактерии и другие микроорганизмы. Это определение, как оказалось впоследствии, не совсем точно, так как в число антибиотиков нужно было бы включить вещества микробного происхождения, которые оказывают не специфическое, а общее антисептическое или консервирующее действие на живые клетки. К таким веществам относятся, в частности, спирты, органические кислоты, перекиси, смолы и др. К тому же антибактериальное действие эти соединения оказывают только в относительно высоких концентрациях. К антибиотикам следует относить только такие вещества, которые в незначительных количествах проявляют специфическое (избирательное) действие на отдельные звенья обмена веществ микробной клетки. Позже в тканях высших растений и животных были найдены соединения, способные в малых количествах специфически подавлять рост микробов. Более того, было показано, что некоторые сходные антибиотики (например, цитринин) могут синтезироваться как микробами, так и высшими растениями. Таким образом, круг организмов-продуцентов антибиотических веществ расширился, что также должно было найти отражение в термине «антибиотики». Установление структуры молекул многих антибиотиков позволило осуществить химический синтез ряда этих соединений без участия организмов-продуцентов.
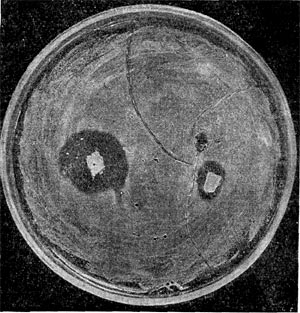
Рис. 194. Пример антагонизма у микробов. Видна зона подавления роста стафилококка вокруг агарового блока с культурой актиномицета.
Дальнейший этап развития химии антибиотиков — изменение (трансформация) молекул этих соединений для получения производных, обладающих рядом преимуществ по сравнению с исходными препаратами. Такое направление исследований объясняется в основном двумя причинами: необходимостью снижения токсичности антибиотиков при сохранении их антибактериального действия; борьбой с инфекционными заболеваниями, вызываемыми устойчивыми к широко применявшимся антибиотикам формами патогенных микроорганизмов. Преимущества производных антибиотиков по сравнению с исходными проявляются также и в изменении растворимости, удлинении срока циркуляции в организме больного и т. д.

Получить производные антибиотиков можно с помощью как химического, так и биологического синтеза. Известен и комбинированный способ получения препаратов. В этом случае ядро молекулы антибиотика формируется при биосинтезе с помощью соответствующих микроорганизмов-продуцентов, а «достройка» молекулы осуществляется методом химического синтеза. Полученные этим способом антибиотики называются полусинтетическими. Так были получены и нашли широкое применение в клинике весьма эффективные полусинтетические пенициллины (метициллин, оксациллин, ампициллин, карбенициллин) и цефалоспорины (цефалотин, цефалоридин) с новыми по сравнению с природными антибиотиками ценными терапевтическими свойствами.
Все эти данные, накопленные в процессе становления и развития науки об антибиотиках, потребовали уточнения термина «антибиотики». В настоящее время антибиотиками следует называть химические соединения, образуемые различными микроорганизмами в процессе их жизнедеятельности, а также производные этих соединений, обладающие способностью в незначительных концентрациях избирательно подавлять рост микроорганизмов или вызывать их гибель. Вполне вероятно, что и эта формулировка с дальнейшим прогрессом антибиотической науки будет уточняться.
В первые годы после открытия антибиотиков их получали с использованием метода поверхностной ферментации. Этот метод заключался в том, что продуцент выращивали на поверхности питательной среды в плоских бутылях (матрацах). Чтобы получить сколько-нибудь заметные количества антибиотика, требовались тысячи матрацев, каждый из которых после слива культуралыюй жидкости необходимо было мыть, стерилизовать, заполнять свежей средой, засевать продуцентом и инкубировать в термостатах. Малопроизводительный способ поверхностной ферментации (поверхностного биосинтеза) не мог удовлетворить потребностей в антибиотиках. В связи с этим был разработан новый высокопроизводительный метод глубинного культивирования (глубинной ферментации) микроорганизмов — продуцентов антибиотиков. Это позволило в короткий срок создать и развить новую отрасль промышленности, выпускающую антибиотики в больших количествах.
Метод глубинного культивирования отличается от предыдущего тем, что микроорганизмы-продуценты выращивают не на поверхности питательной среды, а во всей ее толще. Выращивание продуцентов ведут в специальных чанах (ферментаторах), емкость которых может превышать 50 м3. Ферментаторы снабжены приспособлениями для продувания воздуха через питательную среду и мешалками. Развитие микроорганизмов-продуцентов в ферментаторах происходит при непрерывном перемешивании питательной среды и подаче кислорода (воздуха). При глубинном выращивании во много раз по сравнению с выращиванием продуцента на поверхности среды увеличивается накопление биомассы (из расчета на единицу объема питательной среды), а значит, и возрастает содержание антибиотика в каждом миллилитре культуральной жидкости, т. е. повышается ее антибиотическая активность.
Производственная схема биосинтеза любых антибиотиков включает следующие основные стадии: ферментацию, выделение антибиотика и его химическую очистку, сушку антибиотика и приготовление лекарственной формы. Для осуществления ферментации — биохимического процесса переработки сырья — необходимо иметь питательную среду (сырье) и микроорганизмы, перерабатывающие это сырье. Питательные среды подбирают с таким расчетом, чтобы они обеспечивали хороший рост и развитие продуцента и способствовали максимально возможному биосинтезу антибиотика.
Поднятию производительности антибиотической промышленности, помимо внедрения в практику глубинной ферментации, в огромной степени способствовало использование для биосинтеза новых высокопроизводительных штаммов-продуцентов. Для их получения были разработаны специальные методы селекции. Вследствие большой вариабельности микроорганизмов-продуцентов и быстрой утраты ими исходных свойств (особенно уровня антибиотической активности) необходимо было разработать методы хранения микроорганизмов-продуцентов и поддержания активности, а также способы приготовления посевного материала для засева огромных объемов питательной среды в ферментерах.
Изменения рН в сторону, неблагоприятную для конкурента.
Синтез химических веществ (антибиотиков), которые подавляют рост и размножение.
Классификация антибиотиков по происхождению.
В зависимости от источника получения различают 6 групп антибиотиков:
Антибиотики, полученные из грибов, например рода Penicillium(пенициллин), родаCephalosporium(цефалоспорины).
Антибиотики, полученные из актиномицетов; группа включает около 80% всех антибиотиков. Среди актиномицетов основное значение имеют представители рода Streptomyces, являющиеся продуцентами стрептомицина, эритромицина, левомицетина.
Антибиотики, продуцентами которых являются собственно бактерии. Чаще всего с этой целью используют представителей рода BacillusиPseudomonas. Примерами антибиотиков данной являются полимиксины, бацитрацины, грамицидин.
Антибиотики животного происхождения; из рыбьего жира получают эктерицид, из молок рыб – экмолин, из эритроцитов – эритрин.
Антибиотики растительного происхождения. К ним можно отнести фитонциды, которые выделяют лук, чеснок, сосна, ель, сирень, другие растения. В чистом виде они не получены, так как являются чрезвычайно нестойкими соединениями. Антимикробным действием обладают многие растения, например, ромашка, шалфей, календула.
1 – 5 группы – природные антибиотики.
Синтетические и полусинтетические антибиотики.
Классификация антибиотиков по механизму действия на микробную клетку.
Ингибиторы синтеза компонентов клеточной стенки.
Ингибиторы сборки и пространственного расположения молекул пептидогликана.
Пенициллины и цефалоспорины связывают и инактивируют транспептидазы (пенициллинсвязывающие белки), препятствуя нормальной сборке молекул пептидогликанов.
Ингибиторы синтеза пептидогликанов.
Ванкомицин, циклосерин и бацитрацин ингибируют активность промежуточных предшественников синтеза клеточной стенки.
Препараты, нарушающие функции цитоплазматической мембраны микроорганизмов.
Полимиксины– бактерицидное действие связано с нарушением осмотической резистентности цитоплазматической мембраны.
Полиеновыеантибиотики (нистатин, леворин, амфотерицин) используются какпротивогрибковые препараты; механизм действия – связывание эргостерола цитоплазматической мембраны с последующим выходом низкомолекулярных соединений из клетки.
Грамицидинывызывают нарушение целостности цитоплазматической мембраны.
Ингибиторы синтеза белка.
Самая многочисленная и разнообразная по химической структуре группа антибиотиков. Основной механизм действия большинства препаратов – нарушение функциональных свойств рибосом.
Аминогликозидыреагируют с 30S-субъединицей рибосомы, образуя необратимый комплекс с одним из рибосомальных белков. Тем самым блокируются функции рибосом в целом.
Известны 3 пути нарушения синтеза белка
Блокируется формирование пептидных связей, что опосредует основной путь реализации бактерицидного действия.
Блокируется взаимодействие транспортной РНК с комплексом матричная РНК–рибосома.
Появляются дефектные полипептиды вследствие искажения кода матричной РНК и нарушения считывания генетической информации.
Тетрациклиныоказывают бактериостатическое действие. Механизм действия: взаимодействие с бактериальными 30Sрибосомами с последующим блокированием присоединения транспортной РНК к комплексу рибосома – матричная РНК и нарушением встраивания новых аминокислот в полипептидную цепь.
В настоящее время природные тетрациклины (хлортетрациклин, окситетрациклин) практически не применяются, их вытеснили полусинтетические препараты (доксициклин).
Левомицетин– единственный природный антибиотик, молекула которого содержитнитробензен, опосредующий еготоксичность для клеток бактерий и млекопитающих. Действие бактериостатическое. Механизм действия: взаимодействие с 50Sсубъединицей рибосомы с последующим ингибированием активности пептидилтрансферазы, ответственной за образование пептидных связей.
Макролидысодержат макроциклическое лактонное кольцо с присоединенными комбинациями необычных сахаров (аминосахара, безазотистые сахара). Природные макролиды: эритромицин, олеандомицин, в настоящее время становятся популярными полусинтетические макролиды – рокситромицин и другие.
Действие бактериостатическое, механизм действия – подавление пептидилтрансферазной активности.
Ингибиторы транскрипции и синтеза нуклеиновых кислот, включают вещества, подавляющие синтез ДНК (репликацию) и РНК (транскрипцию).
Хинолоны– антибактериальные препараты широкого спектра действия; механизм активности опосредован ингибированием топоизомеразы (ДНК-гиразы), что препятствует спирализации молекулы ДНК.
Производные нитроимидазола (метронидазол)проявляют селективный бактерицидный эффект в отношении некоторых анаэробов и простейших. Механизм действия – восстановление нитрогрупп препарата в нитрозогидроксиламиногруппы путем переноса электронов, осуществляемое белком, аналогичным ферредоксину теплокровных. Подобное превращение препятствует выходу метронидазола из клетки и приводит к накоплению его в концентрациях, в 10-100 раз превышающих таковые во внеклеточной среде. Депонированный метаболит вызывает множественные нарушения структуры ДНК.
Ингибиторы синтеза РНК (транскрипции) – рифамицины.Молекула рифамицина содержит бициклическую структуру с длинным алифатическим мостиком и нитрифицированной боковой цепью. Действие бактерицидное, опосредовано ингибированием ДНК-зависимой РНК-полимеразе.
Ингибиторы синтеза нуклеотидов составляют большую группу антимикробных агентов; механизм действия связан с ингибированием синтеза фолиевой кислоты за счет нарушения метаболизма пуринов и пиримидинов. Бактериостатическое действие.
Сульфаниламиды– механизм действия – подавление синтеза тимидина и всех пуринов. Препараты – структурные аналоги парааминобензойной кислоты, связывают дигидроптероатсинтетазу, препятствуя образованию интермедиаторов синтеза фолиевой кислоты, служащей коферментом в переносе атома углерода между молекулами.
Диаминопиримидины. Химическая структура препаратов аналогична птеридиновой части фермента (редуктазы), катализирующего восстановление дигидрофолиевой кислоты в тетрагидрофолиевую. Механизм активности направлен на ингибирование синтеза тимидина и пуринов.
Применяется триметоприм, который является структурным аналогом дигидрофолиевой кислоты и связывает дигидрофолатредуктазу. Комбинация триметоприм – сульфаметоксазол (бисептол) оказывает бактерицидное действие, хотя оба компонента – бактериостатики.
Антибиотикдолжен отвечать следующимтребованиям:
При низкой концентрации (10-30 мкг/мл) должен подавлять рост или убивать возбудителя болезни.
Антибиотик должен активно воздействовать на микроорганизмы, чтобы за короткий срок прервать его жизненный цикл.
Активность антибиотика не должна существенно снижаться под действием биологических жидкостей организма.
Антибиотик не должен вредить макроорганизму.
Антибиотик не должен снижать иммунные реакции.
Антибиотик не должен препятствовать выздоровлению.
Существуют 3 условия, при которых антибиотик может оказать бактерицидное или бактериостатическое действие на микробную клетку:
Антибиотик должен проникнуть в клетку.
Антибиотик должен вступить во взаимодействие с так называемой мишенью, т.е. структурой, которая выполняет важную для жизнедеятельности бактерий функцию (например, бактериальной рибосомой, ДНК и др.) и подавить эту функцию.
Антибиотик должен при этом сохранить свою структуру.
Если одно из этих условие не выполняется, бактерия приобретает устойчивость.
При передаче генетической информации клетка приобретает гены, ответственные за синтез тех или иных ферментов, в результате в клетке происходит изменение обычных биохимических реакций и нарушаются условия, необходимые для действия антибиотика.
Антагонизм микробов. Принципы выявления антагонистических взаимоотношений микроорганизмов.
Антибиотики. История открытия.
Классификация антибиотиков. Механизм действия на бактериальную клетку.
Лекарственная резистентность бактерий. Генетические механизмы, роль в экологии микроорганизмов. Пути преодоления.
Контрольные вопросы.
Химиотерапевтические препараты. История открытия. Механизм действия.
Антагонизм микробов Механизм антагонистического отношения. Принципы выявления антагонистических взаимоотношений микроорганизмов.
Антибиотики, определение. История открытия.
Классификация антибиотиков по происхождению.
Классификация антибиотиков по химическому составу.
Классификация антибиотиков по механизму антимикробного действия.
Единицы антибактериальной активности антибиотиков.
Антимикробный спектр действия антибиотиков.
Бактериостатическое и бактерицидное действие антибиотиков.
Антибиотики 1-го, 2-го, 3-го поколения. Недостатки и преимущества.
Лекарственная устойчивость бактерий. Генетические механизмы, роль в экологии микроорганизмов. Пути преодоления.
Борьба с лекарственно-устойчивыми бактериями.
Проблемы химиотерапии вирусных инфекций.
Методы определения чувствительности бактерий к антибиотикам.
Определение толерантности бактерий к антибиотикам.
Ускоренные методы определения чувствительности бактерий к антибиотикам.
Методы выявления -лактамазной активности бактерий.
Антагонизм микробов. Механизм антагонистического действия.
В процессе эволюционного развития между определенными видами и группами микроорганизмов и другими живыми существами установились сложные взаимоотношения. В естественных условиях обитания (почве, воде, организме животных, на растениях) микробы находятся в ассоциациях – сложных обществах, состоящих из разнообразных видов бактерий, грибов, актиномицетов, простейших и других микроорганизмов.
Биологическое явление, связанное с совместным существованием разнообразных видов в едином процессе, получило название симбиоза (сожительство). Формы симбиотических взаимоотношений, определившихся в результате длительного эволюционного развития, могут подвергаться изменениям вследствие смены условий окружающей среды. Иногда трудно определить, что приносит тот или иной симбиоз: пользу, или вред.
Существующие формы симбиоза могут быть разделены на две группы: ассоциативные, благоприятствующие(симбиотические в узком смысле слова) иантагонистические(или конкурентные) взаимоотношения.
Антагонистические взаимоотношения– такой вид симбиоза, при котором один микроорганизм оказывает неблагоприятное воздействие на другой; при этом микробы получают серьезные повреждения и даже гибнут. Повсюду, где обитают микроорганизмы, между ними идет непрерывная борьба за существование, за источник питания, за кислород воздуха, за место обитания. Это связано с образованием и выделением микробами-антагонистами метаболических продуктов, ингибирующих размножение некоторых микроорганизмов. К таким продуктам относятся органические кислоты, изменяющие рН среды, антибиотики, бактериоцины. По-видимому, в условиях, наиболее благоприятных для одного вида, другие всегда испытывают его антагонистическое отношение. Наибольшее число микробов-антагонистов обнаруживается в почве, особенно среди актиномицетов, грибов, спороносных бактерий, выявляются антагонисты и в водоемах (реки, озера).
Антагонизм микробный — угнетение роста одного микроба другим. Является одной из форм взаимоотношений между микроорганизмами в ассоциациях. Антагонистические свойства присущи многим почвенным споровым и гнилостным бактериям, актиномицетам, грибам. Механизм антагонистического действия микробов может быть связан с различными причинами: образованием токсических продуктов метаболизма, антибиотиков.
Антибиотики – биологические вещества или их синтетические аналоги, способные избирательно подавлять рост и размножение микробов без существенного вреда для макроорганизма.
Классификация: по происхождению:
Из грибов (пенициллин)
Из бактерий (полимиксин)
Из актиномицитов (стрептомицин)
Из растений (фитоциты лука и чеснока)
Бактерицидные – убивают напрочь
Бактериостатические – подавляют рост и размножение
Широкого – Гр+- вместе
Узкого – по отдельности
По способу получения:
По направленности действия:
По механизму действия:
Разрушающие клеточную стенку (пенициллин)
Нарушающие ЦПМ (левоин, нистатин)
Нарушающие синтез белка на рибосоме (тетрациклины, левомицетин, макролиты)
Нарушающие синтез и образование НК (сульфаниламиды)
По химической структуре – бета-лактамные (пенициллин).
21. Определение чувствительности микробов к антибиотикам.
1. Метод диффузии в агар (метод дисков)
На поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков.
2.Методы разведения
основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35 о -37 о С проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной ингибирующей концентрацией (МИК).
МИК - наименьшая концентрация антибиотика которая in vitro полностью подавляет видимый рост бактерий.
Терапевтическая концентрация – определенная максимальная концентрация в организме, которая вызывает антимикробное действие.
22. Механизмы возникновения и распространения лекарственной устойчивости.
Антибиотикорезистентность — это устойчивость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистентными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной.
Резистентность микроорганизмов к антибиотикам может быть природной и приобретённой.
Истинная природная устойчивость характеризуется отсутствием у микроорганизмов мишени действия антибиотика или недоступности мишени вследствие первично низкой проницаемости или ферментативной инактивации. При наличии у бактерий природной устойчивости антибиотики клинически неэффективны. Природная резистентность является постоянным видовым признаком микроорганизмов и легко прогнозируется.
Под приобретённой устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Возможны ситуации, когда большая часть микробной популяции проявляет приобретённую устойчивость. Появление у бактерий приобретённой резистентности не обязательно сопровождается снижением клинической эффективности антибиотика. Формирование резистентности во всех случаях обусловлено генетически: приобретением новой генетической информации или изменением уровня экспрессии собственных генов.
Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам:
Модификация мишени действия.
Активное выведение антибиотика из микробной клетки.
Нарушение проницаемости внешних структур микробной клетки.
Формирование метаболического «шунта».
Осложнения: дисбиоз, аллергические реакции, токсическое действие( ототоксичность – стрептомицин, нефротоксичность – гликозиды, гепатотоксичность – тетрациклин) угнетение иммунитета, резистентность, гиповитаминоз.
Антибиотики — вещества природного происхождения, обладающие выраженной биологигеской активностью. Они могут быть получены из микробов, растений, животных тканей и синтетическим путем.
Основными продуцентами антибиотиков служат микроорганизмы, обитающие в почве и воде, где они постоянно вступают между собой в самые разнообразные взаимоотношения. Последние могут быть нейтральными, взаимовыгодными (например, деятельность гнилостных бактерий создает условия для деятельности нитрифицирующих бактерий), но очень часто они являются антагонистическими. И это понятно. Только таким путем в природе могло сложиться сбалансированное сосуществование громадного числа видов живых существ. Антагонистические взаимоотношения между бактериями наблюдал еще Л. Пастер. И. И. Мечников предложил использовать антагонизм между бактериями на пользу человеку. Он, в частности, рекомендовал подавлять активность гнилостных бактерий в кишечнике человека, продукты жизнедеятельности которых, по его мнению, сокращают жизнь человека, молочнокислыми бактериями.
Механизмы микробного антагонизма различны. Они могут быть связаны с конкуренцией за кислород и питательные вещества, с изменением рН среды в сторону, неблагоприятную для конкурента, и т. д.
Одним из универсальных механизмов микробного антагонизма является синтез химических веществ-антибиотиков, которые либо подавляют рост и размножение других видов микроорганизмов (бактериостатическое действие), либо убивают их (бактерицидное действие).
Химиотерапия и химиопрофилактика инфекционных болезней. Антибиотики. Принципы их лечебного применения. Методы определения чувствительности бактерий к антибиотикам. Осложнения при антибиотикотерапии и их предупреждение.
Химиотерапия — специфическое антимикробное, антипаразитарное лечение при помощи химических веществ. Эти вещества обладают важнейшим свойством — избирательностью действия против болезнетворных микроорганизмов в условиях макроорганизма.
Антибиотики — вещества природного происхождения, обладающие выраженной биологигеской активностью. Они могут быть полугены из микробов, растений, животных тканей и синтетигеским путем
Рациональное лечение антибиотиками должно строиться на основе знания индивидуальных особенностей пациента, течения заболевания, биологии возбудителя и его отношения к антибиотикам, а также свойств назначаемого препарата (препаратов). По мнению С. М. Навашина, необходимо придерживаться следующих основных принципов рациональной антибиотикотерапии:
1) выделение и идентификация возбудителя, изучение его антибиотикограммы;
2) выбор наиболее активного и наименее токсичного препарата;
3) определение оптимальных доз и методов введения на основе знания особенностей кинетики антибиотика в организме больного для создания в крови, жидкостях и тканях организма терапевтических концентраций, превышающих в 2—3 раза минимальную подавляющую концентрацию для данного возбудителя;
4) своевременное начало лечения и проведение курсов антибиотикотерапии необходимой продолжительности вплоть до полного закрепления терапевтического эффекта;
5) знание характера и частоты побочных явлений при назначении антибиотиков, особенно в условиях нарушения их распределения в организме больного при некоторых патологических состояниях, например почечно-печеночной недостаточности;
6) комбинирование антибиотиков между собой и с другими препаратами с целью усиления антибактериального эффекта, улучшения их фармакокинетики и снижения частоты побочных явлений.
Чаще всего для определения чувствительности бактерий к антибиотикам используются два метода: метод диффузии в агар с применением стандартных дисков, пропитанных антибиотиком, и метод серийных разведений антибиотика.
--Осложнения. При неоднократном или длительном применении, наблюдаются нежелательные реакции, которые можно разделить на следующие 4 группы: аллергические, токсические, эндотоксические и дисбактериозы.
Аллергические реакции наблюдаются в тех случаях, когда антибиотик выступает в качестве аллергена. Могут носить характер крапивницы, дерматита, сыпи, ринита и т. п. Наибольшую опасность представляет пенициллиновый шок — реакция гиперчувствительности немедленного типа.

Токсические реакции возникают чаще всего в связи с органотропным фармакодинамическим действием антибиотика и при продолжительном лечении. Проявляются в виде поражения вестибулярного аппарата (неомицин, канамицин, стрептомицин), почек (полимиксин, неомицин, мономицин, стрептомицин), периферических нервов, различных поражений ЦНС (циклосерин, неомицин, полимиксин) и других нарушений.
Наиболее тяжелым бывает токсическое воздействие на кровь: агранулоцитоз, апластическая анемия (левомицетин).
Эндотоксические реакции развиваются в тех случаях, когда под влиянием антибиотика происходит массовое разрушение грамотрицательных бактерий, сопровождающееся выделением и поступлением в кровь их эндотоксина (липополисахарида).
Одним из самых частых осложнений, особенно при длительном применении антибиотиков с широким антимикробным спектром, являются дисбактериозы.
5. Микрофлора воздуха. Роль воздуха в распространении возбудителей инфекционных болезней. Методы исследования микрофлоры воздуха.
Микробиологический контроль воздуха проводится с помощью методов естественной или принудительной седиментации микробов. Естественная седиментация (по методу Коха) проводится в течение 5—10 мин путем осаждения микробов на поверхность твердой питательной среды в чашке Петри. Принудительная седиментация микробов осуществляется путем «посева» проб воздуха на питательные среды с помощью специальных приборов (импакторов, импинджеров, фильтров). Импакторы — приборы для принудительного осаждения микробов из воздуха на поверхность питательной среды (прибор Кротова, пробоотборник аэрозоля бактериологический и др.). Импшджеры — приборы, с помощью которых воздух проходит через жидкую питательную среду или изотонический раствор хлорида натрия.
Санитарно-гигиеническое состояние воздуха определяется по следующим микробиологическим показателям:
1. Общее количество микроорганизмовв 1 м 3 воздуха (так называемое общее микробное число, или обсемененность воздуха) — количество колоний микроорганизмов, выросших при посеве воздуха на питательном агаре в чашке Петри в течение 24 ч при 37 °С, выраженное в КОЕ;
2. Индекс санитарно-показательных микробов—количество золотистого стафилококка и гемолитических стрептококков в 1 м 3 воздуха. Эти бактерии являются представителями микрофлоры верхних дыхательных путей и имеют общий путь выделения с патогенными микроорганизмами, передающимися воздушно-капельным путем. Появление в воздухе спорообразующих бактерий — показатель загрязненности воздуха микроорганизмами почвы, а появление грамотрицательных бактерий — показатель возможного антисанитарного состояния.
Для оценки воздуха лечебных учреждений можно использовать данные из официально рекомендованных нормативных документов.
Читайте также: