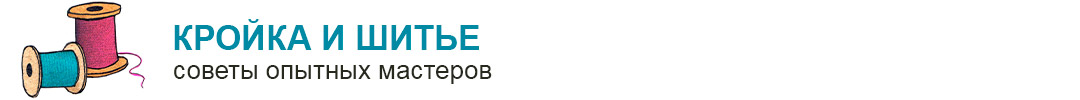Сколько молекул кислорода может связать одна молекула гемоглобина
Обновлено: 25.04.2024
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
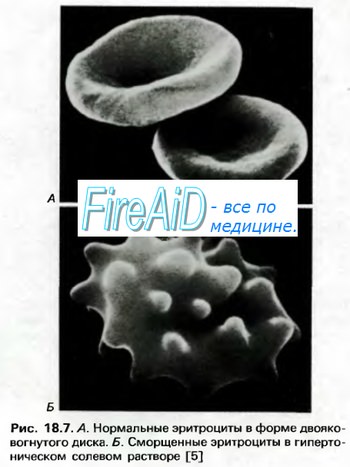
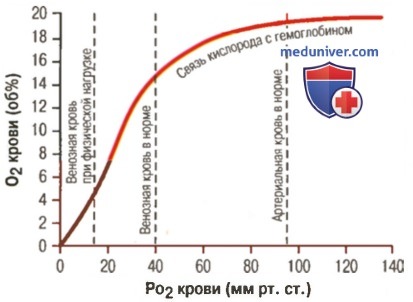
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.
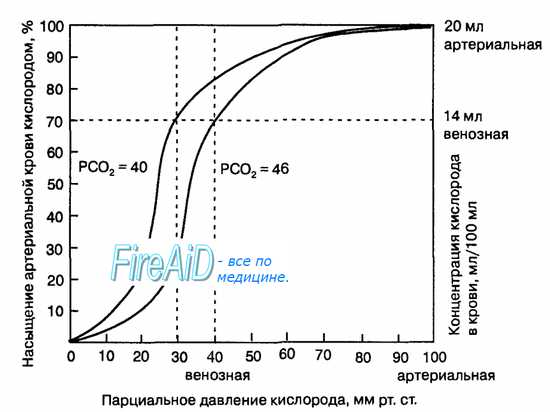
Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
Гемоглобин. Роль гемоглобина в транспорте кислорода
Обычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином.
а) Обратимая связь кислорода с гемоглобином. Химический состав гемоглобина представлен в отдельных статьях на сайте, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком PO2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком PO2, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани.
Кривая диссоциации оксигемоглобина
1. Кривая диссоциации оксигемоглобина. На рисунке выше приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении PO2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%.
В нормальной возвращающейся из периферических тканей венозной крови напряжение О2 составляет около 40 мм рт. ст. и 75% — насыщение гемоглобина кислородом.
2. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15x1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов).
Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода.
3. Количество кислорода, высвобождаемого гемоглобином во время прохождения артериальной крови через ткани. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови (для облегчения понимания просим вас изучить рисунок ниже). При прохождении через капилляры ткани этот объем снижается до 14,4 мл (PO2 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода.
Влияние PO2 крови на количество связанного гемоглобина на 100 мл крови
4. Транспорт кислорода при тяжелой физической нагрузке. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению PO2 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст.
При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 - 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое.
Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение PO2 в мышечной ткани.
Видео физиология газообмена в легких и транспорта газов кровью - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
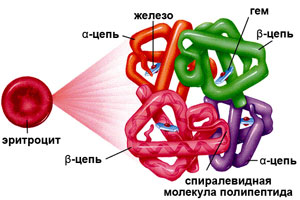
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA - взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) - гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Эффект Бора
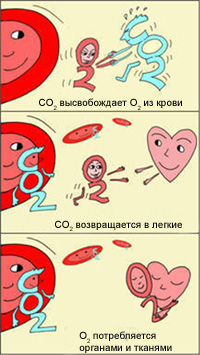
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.

- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.
Другие статьи раздела
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии). Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Mycoplasma pneumoniae - возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
Бактерии – одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
Гипофиз – непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане – гипофизарной ямке турецкого седла. Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
Делеция (ген.) – вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
Механизм обратной связи – система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.

Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2.
Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %.
Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина.
Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Красный пигмент крови человека, сложный железосодержащий белок (хромопротеин, состоящий из глобина и четырех гемов с двухвалентным железом в центре каждого) – гемоглобин (Hb), соединяясь с молекулярным кислородом (O2) в легких, образует оксигенированную форму – оксигемоглобин (HHbO2). Оксигемоглобин, приобретая уникальные свойства и обеспечивая дыхание, как одно из элементарных проявлений жизни, продолжает саму жизнь организма. Например, достаточно ввести окись углерода вместо кислорода или нарушить потребление О2 клетками при попадании цианидов (солей синильной кислоты), которые ингибируют ферментные системы тканевого дыхания, как тут же наступает гибель организма.

Дыхание, на первый взгляд, кажется совсем простым процессом. Между тем, оно основано на взаимодействии многих компонентов, составляющих гигантскую молекулу красного пигмента крови – хромопротеина гемоглобина, который, в свою очередь, отличается многообразием производных, где из их числа несомненный интерес вызывает оксигемоглобин. Итак, оксигемоглобин образуется в легких путем соединения сложного железосодержащего белка гемоглобина с кислородом, поступающим с вдыхаемым воздухом.
Образование и распад оксигемоглобина
В спокойном состоянии тканям человеческого тела достаточно около 0,2 л кислорода в одну минуту, но все меняется при физической нагрузке и чем она интенсивнее, тем больше необходимого для дыхания газа запрашивают ткани. Для удовлетворения их нужд потребность в кислороде может увеличиваться в 10 – 15 раз и составлять до 2, а то и 3 литров О2 в одну минуту. Однако газообразный кислород в данном количестве никак не сможет пробраться в ткани, поскольку он почти не растворим и в воде, и в плазме, то есть, этот элемент в ткани должен доставить какой-то белок, способный соединиться с ним и решить задачу транспорта.

Кровь, как биологическая среда, реализует свои функциональные обязанности по обеспечению дыхания за счет присутствия в ней сложного содержащего железо протеина – гемоглобина, физиологическая роль которого, как транспортного средства кислорода, базируется на способности Hb связывать и отдавать О2 в корреляции с концентрацией (парциальным давлением – P) данного газа в крови. Образование оксигемоглобина осуществляется в паренхиме легких, куда кислород прибывает при дыхании из воздуха окружающей среды.
Процесс образования HHbO2 происходит в доли секунды (0,01 с), поскольку кровь в легких задерживается всего-то на полсекунды. Схематично и коротко образование оксигемоглобина можно представить в следующем виде:
- Попадая в капиллярные сосуды легких, кровь обогащается кислородом, то есть, красный кровяной пигмент к своим 4 гемам присоединяет кислород – идет реакция окисления (оксигенации);
- Кислород связывается с гемами хромопротеина при помощи координационных связей феррума (железо – Fe) и, не изменяя в данном случае валентности последнего (в геме валентность железа всегда – II), переводит его (Hb) в несколько иное состояние;
- Гем железосодержащего протеина представляет собой активный центр, с его помощью хромопротеин в результате вышеуказанной реакции переходит в непрочный комплекс – оксигенированный гемоглобин (HHbO2), который, находясь в красных кровяных тельцах – эритроцитах, с током крови доставляется к клеткам тканей, чтобы через распад оксигемоглобина и выделения в процессе диссоциации кислорода, обеспечить их дыхание.
Таким образом, результатом реакции оксигенации становится образование оксигемоглобина, подкисление биологической жидкости, снижение ее щелочного резерва, то есть, ее умения связывать углекислоту (СО2), которое, разумеется, на тот момент снижается.
Железосодержащий протеин, насытившись в легочной паренхиме кислородом и приобретя оксигенированную форму, уносит О2 к тканям, в капиллярных сосудах которых его концентрация в крови резко понижена. Там происходит распад оксигемоглобина (диссоциация), кислород уходит на тканевое дыхание, гемоглобин забирает отработанный углекислый газ, превращаясь в другую физиологическую модель – карбогемоглобин (HHbCO2), и в этом качестве отправляется в главный орган дыхания, чтобы обменять CO2 на очередную порцию необходимого организму газа.

Кривая образования и распада (диссоциации) оксигемоглобина
Агентом, гарантирующим быстрое насыщение железосодержащего белка кислородом (образование оксигемоглобина), выступает высокое напряжение (парциальное давление) О2 в легочных альвеолах (порядка 100 мм рт. ст.).
Корреляцию между степенью насыщения красного кровяного пигмента кислородом и парциальным давлением O2 (PO 2) выражают в виде S-образной кривой (сигмоиды), которую называют кривой диссоциации оксигемоглобина.

Свойственная красному кровяному пигменту S-образная (сигмоида) кривая диссоциации оксигемоглобина свидетельствует о том, что контактирование первой молекулы О2 с одним из гемов Hb открывает путь присоединению других молекул элемента остальными тремя гемами. Кривой насыщения железосодержащего белка кислородом принадлежит немалая физиологическая значимость – S-образная конфигурация позволяет крови обогатиться данным газом при изменениях концентрации кислорода в биологической жидкости в довольно обширных интервалах. К примеру, не следует ожидать таких особенных расстройств дыхательной функции крови, как выраженное кислородное голодание (гипоксия), при подъеме на высоту до 3,5 км над уровнем моря или во время перелета на самолете. Хотя PO 2 во вдыхаемом воздухе сильно понизится, концентрация кислорода в крови будет находиться на достаточно высоком уровне, чтобы обеспечить насыщение Hb данным газом. На это указывает и отлогий график формирования и распада оксигемоглобина на верхнем его отрезке (верхний отрезок кривой свидетельствует о течении процесса насыщения О2 красного пигмента крови в легочной паренхиме и находится в пределах 75 – 98%).
Кривая диссоциации оксигемоглобина может быть разделена на 4 отрезка, каждому их которых соответствует определенный период образования оксигемоглобина (зависимость скорости насыщения хромопротеина кислородом от парциального давления газа в крови):
- 0 – 10 мм рт. ст. – гемоглобин не спешит насыщаться;
- 10 – 40 мм рт. ст. – оксигенация резко ускоряется (стремительный подъем кривой), доходя до 75%;
- 40 – 60 мм рт. ст. – оксигенация заметно замедляется, потихоньку добираясь до 90%;
- Значения PO2 пересекают отметку 60 мм рт. ст. – насыщение идет слабо (линия лениво ползет вверх). Однако кривая медленно продолжает стремиться к отметке 100%, но, так и не достигнув ее, останавливается на уровне 96 – 98%. Кстати, и такие показатели насыщения Hb кислородом отмечаются только у молодых и здоровых людей (PO2 артериальной крови ≈ 95 мм рт. ст., легочных капилляров – ≈ 100 мм рт. ст.). С возрастом дыхательные способности крови снижаются.
Несовпадение парциального давления кислорода артериальной крови и смеси газов в альвеолах легких трактуется:
- Некоторыми разногласиями между интенсивностью тока крови и вентилированием разных отделов главного органа дыхания – легких;
- Притоком незначительного объема крови из бронхиальных вен в венозные сосуды легких (шунтирование), где, как известно, течет артериальная кровь;
- Прибытием доли крови из коронарных вен в левый желудочек сердца посредством тебезиевых вен (вены Тебезия-Вьессена), в которых проходимость возможна в обоих направлениях.
Между тем, причины, вследствие которых кривая образования и диссоциации оксигемоглобина приобрела сигмоидную форму, пока остаются не до конца выясненными.
Смещение кривой диссоциации оксигемоглобина
Но кривая диссоциации оксигемоглобина, о которой идет речь выше, справедлива, если в организме все нормально. В других ситуациях график может сдвигаться в ту или иную сторону.
В числовом выражении сродство гемоглобина к кислороду обозначается величиной P50 – напряжение полунасыщения красного пигмента крови кислородом или иными словами: парциальное напряжение О2, при котором 50% Hb пребывает в форме оксигемоглобина (оптимальные условия: рН – 7,4, tº – 37ºC). Нормальные значения этого показателя в артериальной крови приближаются к величине 34,67 гПа (26 мм рт. ст.). Смещение графика вправо указывает на то, что способность красного кровяного пигмента соединяться с кислородом снижается, что, естественно, увеличивает значения P50. И, наоборот – смещение кривой влево говорит об увеличении сродства этого хромопротеина к кислороду (↓P50.).

Ходу сигмоиды помогают некоторые факторы, повышающие обогащение крови кислородом и таким образом участвующие в тканевом дыхании, поэтому названные вспомогательными:
- Повышение водородного показателя (pH) крови (эффект Бора), поскольку способность гемоглобина присоединять кислород связана с водородным показателем (pH) данной биологической среды (гемоглобин представляет одну из четырех буферных систем и влияет на регуляцию кислотно-основного баланса, поддерживая pH на нужном уровне: 7,36 – 7,4). Следовательно, чем выше водородный показатель, тем активнее ведет себя гемоглобин в отношении кислорода и наоборот – снижение pH отнимает возможности хромопротеина присоединять кислород, например: ↓pH до 7,2 заставит график отклоняться вправо (≈ на 15%), ↑pH до 7,6 передвинет кривую диссоциации оксигемоглобина влево (≈ на 15%);
- Отделение углекислого газа от карбогемоглобина в легких и выход СО2 с выдыхаемым воздухом (эффект Бора-Вериго) на фоне повышения водородного показателя создает условия для жадного насыщения гемоглобина кислородом (образование оксигемоглобина в легких);
- Возрастание уровня значимого для обмена фосфата – 2,3-дифосфоглицерата (2,3-ДФГ), содержание которого в крови меняется в зависимости от условий протекания обменных процессов;
- Снижение температуры в легких (в тканях она выше, нежели в легких) и чем ниже упадет tº, тем больше способностей присоединять кислород появляется у железосодержащего белка (при повышении температуры идет обратный эффект).
Уровень красного пигмента в крови, а также его способность присоединять кислород (кривая диссоциации оксигемоглобина) в некоторой степени подвержены возрастным колебаниям. Так, у младенцев, только-только известившим мир о своем появлении первым криком, количество гемоглобина заметно выше, что объясняется присутствием фетального гемоглобина, который, как известно, обладает повышенным сродством к кислороду. Красный пигмент крови стариков, напротив, постепенно снижает способности связывать кислород.
В заключение хочется заметить, что гемоглобин не только имеет сродство к кислороду и довольно легко соединяется с углекислым газом. Кроме физиологических соединений красного кровяного пигмента при определенных условиях возникают связи с другими газами, в частности – с угарным газом (CO) и оксидом азота (NO), причем соединение происходит также непринужденно
Высокое сродство Hb к угарному газу влечет образование карбоксигемоглобина (HHbCO), который препятствует соединению хромопротеина с кислородом, а в результате этого ткани остаются без O2. К чему это может привести – всем известно: при отравлении угарным газом высок риск смертельного исхода, если вовремя не помочь человеку.
При отравлении оксидом азота или парами нитробензола гемоглобин переходит в метгемоглобин (HHbOH) с изменением валентности железа (II → III). Метгемоглобин также не позволяет кислороду соединиться с гемоглобином, в итоге – наступает кислородное голодание тканей, создается угроза жизни организма.
Читайте также: