Какие соединения позволяют пришить лиганд с образованием пептидной связи
Обновлено: 26.07.2024
Именно пептидная связь является основой построения всех белковых молекул, из которых, в конечном счете, образуется вся живая материя. Особенности строения пептидной связи, ее структура оказали огромное влияние на саму возможность существования жизни на нашей планете. О том, что такое пептидная связь, как она образуется и какими свойствами обладает, читайте дальше.
Определение
Пептидная связь это связь, возникающая между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-COOH). Две соединенные одна с другой кислоты образуют дипептид, три – трипепетид и так далее. Длинные цепи подобного рода зовутся полипептидами и белками.
Также академическое определение пептидной связи звучит так: пептидная связь – это вид химической связи, возникающей вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Само же слово «пептид» происходит от греческого «питательный» и означает семейство веществ, молекулы которых построены из двух или более остатков аминокислот, соединенных в цепь пептидными связями —C(O)NH—.
Образование
Как образуется пептидная связь? Образование пептидной связи происходит внутри клеток на рибосомах при активном участии ферментов с затратой энергии. Аминокислоты при этом, будучи мономерами, играют роль таких себе строительных блоков белков. Для синтеза белка живыми организмами используется 20 видов различных аминокислот.
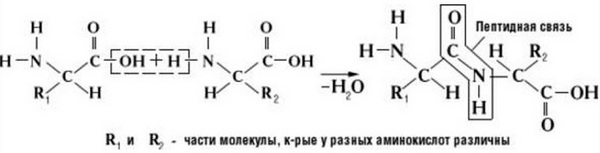
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Вот так процесс образования пептидной связи в молекуле выглядит схематически.
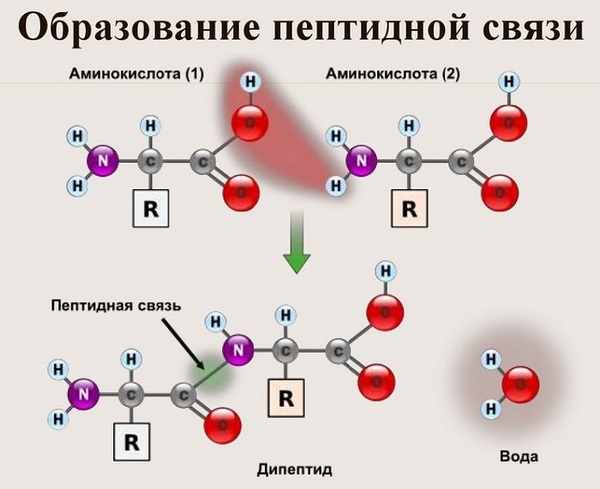
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Свойства
Пептидная связь, которая имеет место при первичной структуре белков, не является полностью одинарной. Длина ее равна 0,132 нм. Это среднее значение между истинной двойной и одинарной связями.
Важными свойствами пептидной связи являются копланарность и трансположение, далее подробно их поясним.
Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
Строение
В чем особенности строения пептидной связи? В амидной группе –CO-NH- углеродный атом существует в форме sp 2 -гибридизации. К примеру, электронная пара атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом. Тогда электронная плотность пептидной группы сместится к кислороду. В результате подобного сопряжения выровняются длины связей внутри радикала.
Структура подобной пептидной связи и формула отражена на картинке.
Методы определения связей
Наилучшим методом для определения пептидных связей является биуретовая реакция. Такое название она имеет потому, что впервые эта реакция была использована для получения биурета, который хотя и не является аминокислотой, но обладает при этом двумя пептидными связями.
Сам механизм определения сводится к тому, что аминокислоты, способные образовать как минимум две пептидные связи в щелочной среде при добавлении сульфата меди образуют медьсодержащее комплексное соединение фиолетового цвета.
Рекомендованная литература и полезные ссылки
Видео
Автор: Павел Чайка, главный редактор журнала Познавайка
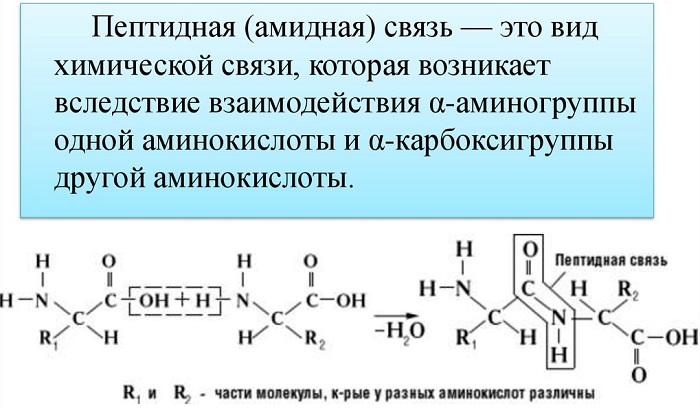
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами - строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
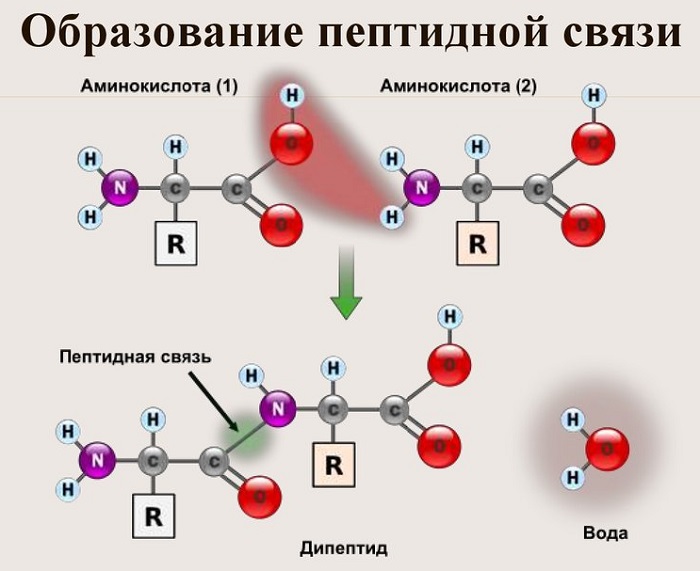
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
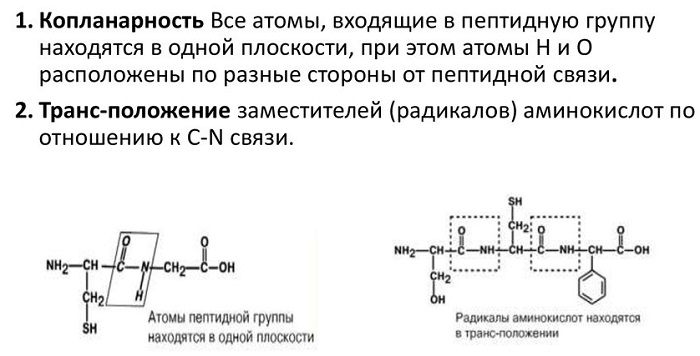
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
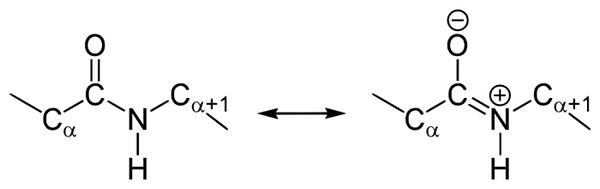
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.

В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В амидной группе -СО-NH- углеродный атом существует в форме sp 2 -гибридизации. Неподеленная пара электронов атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом.
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:

Методы определения пептидных связей
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:

Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Пептидные связи появляются благодаря реакции аминокислоты с аминокислотой. В составе аминокислот есть две группы – аминогруппа и группа карбоксильная. Пептидная связь появляется при условии, что реакция дегидрации имеет место между аминогруппой в одной аминокислоте и карбоксильной группой в иной. Карбоксильная группа теряет атом кислорода, а аминогруппа – пару атомов водорода, при этом образуется вода и пептид.
Пептидная связь
Появление пептидного соединения происходит в момент, когда азот из аминогруппы связывается с углеродом карбоксильной. Эта связь является ковалентной и некоторыми учеными называется также амидной. Образование связи осуществляется благодаря гидролизу, а не синтезу, поэтому не требует дополнительного источника энергии. Биосинтез пептидов происходит буквально за несколько секунд, но воссоздание такой же реакции в лаборатории может быть делом длительным. Однако образованные связи являются стабильными, и в отсутствии катализаторов в водном растворе пептиды могут существовать тысячи лет.
Если две аминокислоты связываются друг с другом, то появляется дипептид, если три – то трипептид. Количество аминокислот, что могут создавать сложные полимерные структуры, почти не ограничено. Конец аминокислоты, у которой связана карбоксильная группа, называется N-концом. С другой же стороны находится С-конец, то есть свободная карбоксильная группа второй участвующей в образовании соединения аминокислоты. Пептидная связь крайне распространена в организме, часто она становится основой для формирования белков. К пептидным соединениям относят и гормоны, в частности, окситоцин. Синтез пептидов в организме человека осуществляется во всех клетках, включая нейроны мозга.

Резонанс и биосинтез
Пептиды имеют особое значение в функционировании и биосинтезе белков, потому что именно они в конечном итоге определяют структуру белка. Их состав позволяет осуществить дополнительный переход пары электронов между кислородом и углеродом с образованием двойной связи и резонанса. Это процесс крайне динамичный, потому что электроны находятся в вечном движении, поэтому пептидные соединения и обладают повышенной биологической активностью. В пептидной связи присутствует дипольный момент, образованный благодаря наличию разных зарядов на двух концах соединения. Возможность использовать несколько электронов, а также дополнительно присоединять к связи аминокислоты, делает пептиды идеальными переносчиками информации, а их резонанс обеспечивает высокую биологическую активность. Полипептиды способны обеспечивать регулировку большинства биологических процессов, включая аппетит, восстановление и регенерацию, пищеварение, настроение, высшую нервную деятельность, артериальное давление и обладать гормональной активностью.
Необычное соединение
Из-за характера связи у нее ограничивается свобода вращения, и пептиды становятся стабильными соединениями. Также в полипептидах замечена локализация аминокислот в некоторых определенных областях. Предполагается, что эти области могут быть характерны для разных структур организма и определять предназначение пептида. Но при этом пептиды с трудом поддаются исследованию и так многообразны, что мы представления не имеем, как именно расположение аминокислот в связи определяет воздействие пептида. Исследования в области пептидных связей еще продолжаются.
Аминокислоты в полипептидной цепи связаны амидной связью, которая образуется между α-карбоксильной группой одной и α-аминогруппой следующей аминокислоты (рис. 1). Образующаяся между аминокислотами ковалентная связь получила название пептидной связи.Атомы кислорода и водорода пептидной группы при этом занимают трансположение.
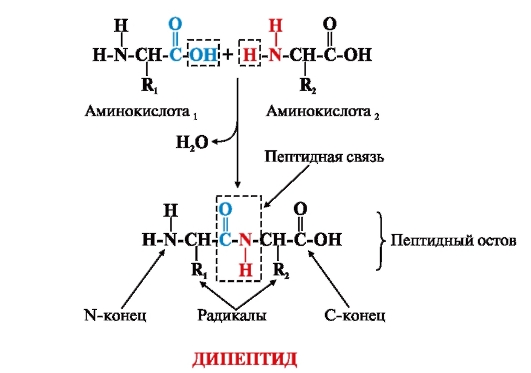
Рис. 1. Схема образования пептидной связи.В каждом белке или пептиде можно выделить: N-конецбелка или пептида, имеющий свободную а-аминогруппу (-NH2);
С-конец, имеющий свободную карбоксильную группу (-СООН);
Пептидный остов белков, состоящий из повторяющихся фрагментов: -NH-СН-СО-; Радикалы аминокислот(боковые цепи) (R1и R2)- вариабельные группы.
Сокращенная запись полипептидной цепи, так же как и синтез белка в клетках, обязательно начинается с N-конца и заканчивается С-концом:
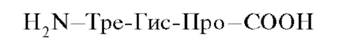
Названия аминокислот, включенных в пептид и образующих пептидную связь, имеют окончания -ил.Например, трипептид, приведенный выше, называется треонил-гистидил-пролин.
Единственной вариабельной частью, отличающей один белок от всех остальных, является сочетание радикалов (боковых цепей) аминокислот, входящих в него. Таким образом, индивидуальные свойства и функции белка обусловлены структурой и порядком чередования аминокислот в полипептидной цепи.
Полипептидные цепи разных белков организма могут включать от нескольких аминокислот до сотен и тысяч аминокислотных остатков. Их молекулярная масса (мол. масса) также колеблется в широких пределах. Так, гормон вазопрессин состоит из 9 аминокислот, мол. масса 1070 кД; инсулин - из 51 аминокислоты (в 2 цепях), мол. масса 5733 кД; лизоцим - из 129 аминокислот (1 цепь), мол. масса 13 930 кД; гемоглобин - из 574 аминокислот (4 цепи), мол. масса 64 500 кД; коллаген (тропоколлаген) - примерно из 1000 аминокислот (3 цепи), мол. масса ~130 000 кД.
Свойства и функция белка зависят от структуры и порядка чередования аминокислот в цепи, изменение аминокислотного состава может их сильно изменить. Так, 2 гормона задней доли гипофиза - окситоцин и вазопрессин - являются нанопептидами и отличаются 2 аминокислотами из 9 (в положении 3 и 8):
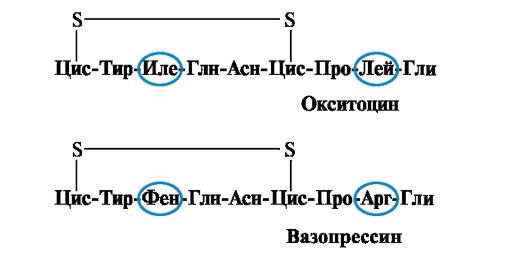
Основной биологический эффект окситоцина заключается в стимуляции сокращения гладкой мускулатуры матки при родах, а вазопрессин вызывает реабсорбцию воды в почечных канальцах (антидиуретический гормон) и обладает сосудосуживающим свойством. Таким образом, несмотря на большое структурное сходство, физиологическая активность этих пептидов и ткани-мишени, на которые они действуют, отличаются, т.е. замена всего 2 из 9 аминокислот вызывает существенное изменение функции пептида.
Иногда совсем небольшое изменение структуры крупного белка вызывает подавление его активности. Так, фермент алкогольдегидрогеназа, расщепляющий этанол в печени человека, состоит из 500 аминокислот (в 4 цепях). Активность его у жителей Азиатского региона (Япония, Китай и др.) намного ниже, чем у жителей Европы. Это связано с тем, что в полипептидной цепи фермента происходит замена глутаминовой кислоты на лизин в положении 487.
Взаимодействиями между радикалами аминокислот играют большое значение в стабилизации пространственной структуры белков, можно выделить 4 типа химических связей: гидрофобная, водородная, ионная, дисульфидная.
Гидрофобные связивозникают между неполярными гидрофобными радикалами (рис. 2). Они играют ведущую роль в формировании третичной структуры белковой молекулы.
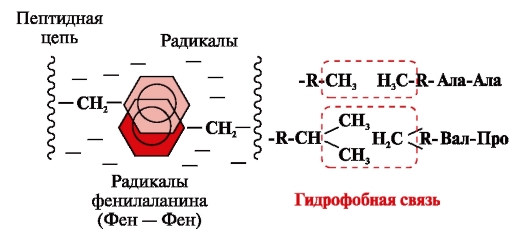
Рис. 2. Гидрофобные взаимодействия между радикалами
Водородные связи- образуются между полярными (гидрофильными) незаряженными группами радикалов, имеющими подвижный атом водорода, и группами с электроотрицательным атомом (-О или -N-) (рис. 3).
Ионные связиобразуются между полярными (гидрофильными) ионогенными радикалами, имеющими противоположно заряженные группы (рис. 4).
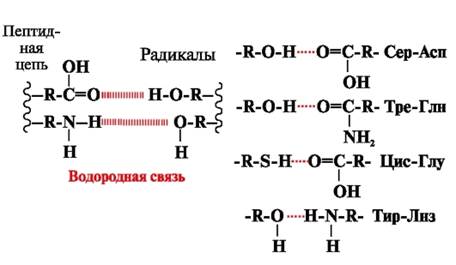
Рис. 3. Водородные связи между радикалами аминокислот
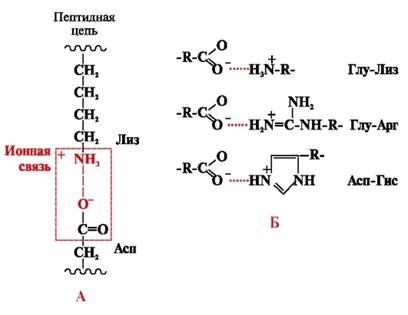
Рис. 4. Ионная связь между радикалами лизина и аспарагиновой кислоты (А) и примеры ионных взаимодействий (Б)
Дисульфидная связь- ковалентная, образуется двумя сульфгидрильными (тиольными) группами радикалов цистеина, находящимися в разных местах полипептидной цепи (рис. 5). Встречается в таких белках, как инсулин, инсулиновый рецептор, иммуноглобулины и др.

Дисульфидные связи стабилизируют пространственную структуру одной полипептидной цепи или связывают между собой 2 цепи (например, цепи А и В гормона инсулина) (рис. 6).
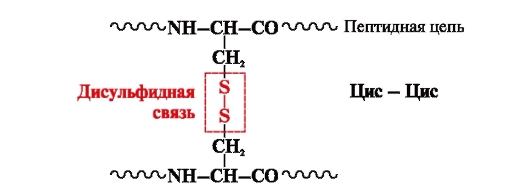
Рис. 5. Образование дисульфидной связи.
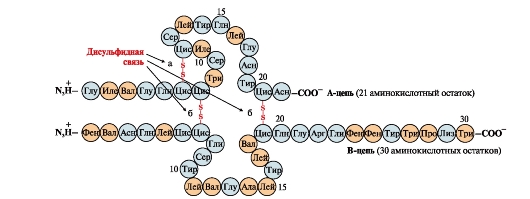
Рис. 6. Дисульфидные связи в молекуле инсулина.Дисульфидные связи: между остатками цистеина одной цепи А(а), между цепями Аи В(б). Цифры - положение аминокислот в полипептидных цепях.
В определенных условиях (например, при воздействии определенных ферментов), аминокислоты способны реагировать друг с другом. В результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислотывозникаетпептидная связь.
Образование пептидной связи можно представить себе, как отщепление молекулы воды от присоединяющихся к друг другу карбоксильной и аминогрупп (Рис. 1.9):
Рис. 1.9 Образование пептидной с вязи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм, что является средним значением между истинной одинарной связью C-N (0.149 нм) и истинной двойной связью C=N (0,127 нм). По некоторым данным, пептидная связь является частично двойной и частично одинарной:
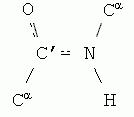
Рис 1.10. Пептидная связь
Пептидная связь имеет плоскую структуру(планарная связь), т. е. все четыре атома (C, N, O, H) лежат в одной плоскости, и характеризуется определённой жёсткостью, т. е..
Эти свойства пептидной связи обеспечиваются так называемой sp 2 -гибридизацией электронов N и С' атомов,отсутствием вращения вокруг C´-N связи
Давайте более подробно остановимся на тонкой (электронной) структуре пептидной связи.
Электронные формулы C, N и O:
Углерод, азот и кислород относятся ко 2-му периоду, т. е. имеют два энергетических уровня. На втором (внешнем) энергетическом уровне локализованы два энергетических подуровня: s и p.Электронные формулы этих элементов имеют следующий вид:
Углерод C 1s 2 2s 2 2p 2
Азот N 1s 2 2s 2 2p 3
Кислород O 1s 2 2s 2 2p 4
Рис. 1.11 Энергетические уровни атома углерода
Образованию ковалентной пептидной связи предшествует sp 2 -гибридизация атомных орбит атомов углерода и азота.
Рис. 1.12 sp 2 гибридизация
sp 2- гибридизация преобразует одну сферическую s- и две вытянутые p-орбиты электронов атома в три sp 2 -орбиты. Эти три орбиты вовлекают атом в три ковалентные связи, лежащие в одной плоскости.
Вовлеченные в sp 2 -гибридизацию электроны ковалентно связанных C' и N атомов создают "делокализованное" электронное облако, охватывающее оба эти атома, и распространяющиеся также — через связь С-О — на атом О (именно поэтому связи C'=N и C=O рисуются как равноправные "полуторные").
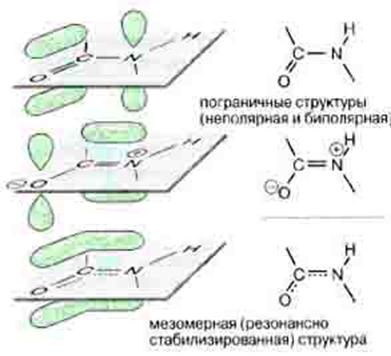
Рис. 1.13 Делокализация ковалентной связи при образовании пептидной связи
Ковалентная связь считается локализованной, если ее электронная пара находится в поле двух ядер и связывает только два атома.
Делокализованная связь – связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов. Такая делокализация (рассредоточение) электронов характерна для сопряженных π-связей, т.е. кратных связей, чередующихся с одинарными.
Рассредоточение электронов – энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации р-электронов является π-перекрывание р-атомных орбиталей соседних sp 2 -атомов.
Однако у C и N атомов есть еще p-электроны кроме тех, что уже задействованных в sp 2 орбитах. И так как эти p-орбиты имеют форму "восьмерок", перпендикулярных всем трем sp 2 -орбитам, то дополнительная связь этих p-электронов — связь, требующая сближения "восьмерочных" орбит и "обобществления" (т.е. переходов с атома на атом) находящихся на них электронов, - это обобществление p-электронов препятствует вращению вокруг С'-N связи.
Атом кислорода карбоксильной группы и атом водорода аминогруппы могут находятся в цис- или транс-положении относительно связи –C-N-.
Рис. 1.14 Цис- и транс-форма пептидной связи
Читайте также: