Автономный рост опухоли можно связать
Обновлено: 26.04.2024
Механизмы роста опухоли - рака
Различные здоровые ткани очень сильно отличаются друг от друга по уровню клеточных делений и числу активно пролиферирующих клеток. Примерами активно пролиферирующих тканей могут быть слизистая кишки, красный костный мозг, волосяные фолликулы и регенерирующие после повреждений ткани, например после хирургической операции или инфекционного поражения.
На рисунке изображено идеализированное представление о том, как проходит пролиферация и дифференцировка в нормальной ткани. Видно, что стволовая клетка или клетка-предшественник дает начало развитию пролиферативного пула клеток, из которого клетки затем дифференцируют, каждая по своему пути развития. Когда в конце такого пути развития клетка становится зрелой, она теряет способность к дальнейшему размножению вплоть до своей гибели.
Такая модель, хотя и с некоторыми оговорками, может быть принята для описания развития рака. В процессе развития опухоли действительно существуют и свои клетки-предшественники и зрелые клетки, но неясно, на каком этапе развития происходит инициация перерождения здоровой клетки в опухолевую. Тем не менее приведенная схема помогает объяснить некоторые аспекты опухолевого роста. Первоначально деление стволовых клеток предшественников происходит довольно интенсивно, но по мере роста клеточного пула заданное «программно» число новых делений со временем уменьшается. Стимулы к смерти клетки также заранее запрограммированы, и этот процесс находится под контролем генетического аппарата.
Запрограммированная смерть клетки получила название апоптоза. При этом в клетке наблюдаются такие морфологические изменения, как конденсация ядерного материала с последующим вскипанием цитоплазмы и разрывом клеточной мембраны. Плотность ядра при апоптозе растет, что связано с ростом активности клеточных эндонуклеаз, расщепляющих ДНК. Также происходит высвобождение в цитоплазму митохондриальных ферментов. Таким образом, можно сказать, что любая нормальная клетка может получить сигнал на прекращение делений и смерть. Размножение клеток в популяции стимулируется генами bcl-2, ras и LMP-1, в то время как ген р53 препятствует дальнейшей пролиферации.
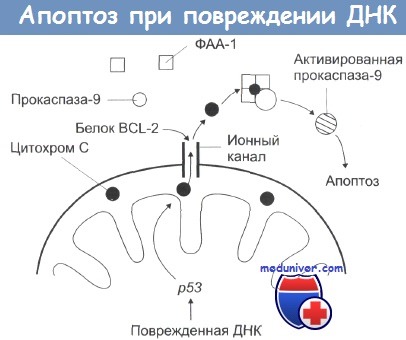
- Повреждения ДНК и активация белка р53 инициируют высвобождение цитохрома С из митохондрий по ионоселективным каналам во внешней митохондриальной мембране.
- Цитохром С вызывает олигомеризацию фактора активации апоптоза-1 (ФАА-1), который связывается с прокаспазой-9 и активирует ее.
- Активированная прокаспаза-9 запускает механизм апоптоза.
- Белок BCL-2 блокирует ионные каналы и является, таким образом, антиапоптозным фактором. Белок ВАХ стимулирует выброс цитохрома из митохондрий, способствуя ускорению апоптоза
Применение радио- и химиотерапии приводит к уменьшению размеров опухоли. Этот эффект достигается в основном за счет поздних опухолевых клеток, неспособных к самовосстановлению. В то же время для предотвращения повторного роста опухоли очень важно убить активно делящиеся клетки-предшественники или стволовые клетки.
Активной фракцией опухоли называется доля ее интенсивно пролиферирующих клеток по отношении ко всей опухолевой массе. Так как многие раковые клетки характеризуются продолжительным клеточным циклом, возможны недооценки величины активной фракции и, как следствие, недооценки пролиферативного потенциала опухоли в целом. Эти медленно растущие клетки наименее чувствительны к химиотерапевтическому воздействию, особенно к агентам, действующим на клеточный цикл. Тем не менее циторедуктивная терапия, по-видимому, может уменьшать продолжительность клеточного цикла указанных клеток.
Нормальные ткани развиваются и растут до тех пор, пока пролиферация клеток не становится сбалансированной с их естественной убылью. При этом масса ткани остается неизменнои довольно продолжительное время, если только не изменяются внешние условия, как, например, это происходит с тканями молочной железы в течение менструального цикла или при беременности. При раке происходит нарушение регуляторных механизмов тканевого роста, и опухоль постоянно увеличивается в размерах.
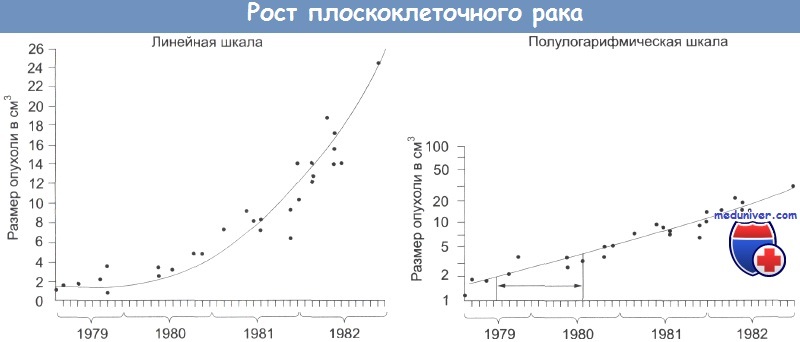
Больной страдал периферической плоскоклеточной карциномой, которая не лечилась по причине слабоумия и гипертонии.
В течение почти 4 лет эта опухоль, почти сферическая по форме, медленно росла, демонстрируя экспоненциальный рост и удваиваясь в объеме каждый год (горизонтальная стрелка).
В нормальных соматических клетках каждое последующее деление сопровождается отщеплением фрагментов от концевой последовательности повторяющихся нуклеотидов, прикрепленных к каждой хромосоме. Эта последовательность получила название теломера. Когда хромосомы полностью утрачивают свои теломеры, деление клеток прекращается. Катализатором реакции образования теломеров является фермент теломераза, который обладает свойствами обратной транскриптазы.
Повышенная экспрессия теломеразы обнаружена в опухолевых клетках больных различными видами рака, и это может быть одним из механизмов, определяющих непрерывный рост опухоли.
Следует особо подчеркнуть, что непрерывный рост вовсе не означает быстрого роста. На рисунке представлен график удвоения в объеме плоскоклеточного рака почти сферической формы в зависимости от времени. Видно, что карцинома демонстрирует медленный экспоненциальный рост, удваивая свои размеры примерно за 1 год. В течение всего этого роста опухоль как прирастает новыми клетками, так и теряет часть старых. Гибель опухолевых клеток частично связана с нарушениями проводимости сосудов, питающих опухоль. Неадекватное снабжение клетки питательными веществами начинается уже тогда, когда клетка удалена более чем на 150 мкм от ближайшего питающего капилляра. Очень часто в центре многих раковых опухолей человека образуются зоны обширного некроза, где клетки полностью отрезаны от кровоснабжения.
Другими причинами гибели раковых клеток могут быть нарушения механизма митотического деления (возможно, связанные с хромосомными аномалиями) и гибель клеток в результате иммунных атак организма. Причем эта иммунная активность может быть как специфическая, направленная против конкретной опухоли, так и неспецифическая, вызванная общим воздействием опухоли на организм.

а - Две кинетические модели опухолевого роста.
Кривая А представляет собой экспоненциальный рост,
кривая Б — прогрессивное замедление роста по мере увеличения размеров опухоли, получившее название гомпертциана роста.
б - Продолжительность жизни опухоли. Опухоль клинически выявляется после 33 удвоений своего объема.
Лечение приводит к уменьшению опухолевой массы, но после 4,5 лет опухоль вновь клинически детектируется.
Исследования культур клеток различных злокачественных опухолей человека показали широкий разброс по времени удвоения клеточной массы в зависимости от вида рака. До сих пор не совсем понятно, на каком этапе своего развития с момента зарождения до явно выраженных клинических проявлений опухоль вступает в фазу бурного роста. Для ряда человеческих опухолей был экспериментально доказан экспоненциальный рост. Если взять в качестве примера случай, проиллюстрированный на рисунке, и экстраполировать кривую назад в прошлое, то мы получим, что при условии постоянного экспоненциального роста опухоль возникла за 30 удвоений (30 лет) до момента ее клинического обнаружения. У нас нет возможности узнать, проходит ли более быстрый рост спонтанно возникшей опухоли в самом начале ее развития с последующим замедлением или нет.
Для некоторых визуально детектируемых опухолей показано, что с течением времени их рост замедляется, такая кривая роста носит название гомпертцианы. В то же время совершенно ясно, что, независимо от скорости роста злокачественной опухоли, к моменту обнаружения ее первых клинических проявлений она проходит уже значительный путь своего развития. Этот факт имеет прямое отношение к успехам или неудачам мониторинговых программ по раннему обнаружению рака. Точно так же можно подсчитать, что если мы имеем опухоль с периодом удвоения в 70 дней, а проведенное лечение вызвало редукцию роста на 10 удвоений, должно пройти примерно 2 года до вторичного возникновения опухоли, при условии что темпы ее роста остались неизменными.
Кстати, здесь кроется причина частых неправомерных оценок эффективности лечения, если наблюдения за больными после его проведения не велись достаточно долгое время. Суммируя все вышесказанное, можно заключить: следует всегда помнить, что, когда мы приступаем к лечению клинически подтвержденных раковых опухолей, мы имеем дело с заболеванием, которое уже находится на поздних этапах своего развития.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Автономный рост опухоли характеризуется отсутствием контроля за пролиферацией и дифференцировкой клеток организма-опухоленосителя. Инвазия опухоли протекает в три фазы и обеспечивается определенными генетическими перестройками. Первая фаза инвазии опухоли характеризуется ослаблением контактов между клетками. Во второй фазе опухолевая клетка секретирует протеолитические ферменты и их активаторы, которые обеспечивают деградацию экстрацеллюлярного матрикса, освобождая тем самым ей путь для инвазии.
Стадия метастазирования - заключительная стадия морфогенеза опухоли, которая связана с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим, кровеносным сосудам, периневрально, имплантационно, что явилось основой выделения видов метастазирования.
Автономный рост опухоли
Автономный рост опухоли характеризуется отсутствием контроля за пролиферацией и дифференцировкой клеток организмом-опухоленосителем. Это вовсе не означает, что опухолевые клетки находятся в каком-то пролиферативном хаосе. В действительности клетки опухолей переходят на аутокринный или паракринный механизм регулирования своего роста.
При аутокринной стимуляции роста опухолевая клетка сама продуцирует факторы роста или онкобелки-аналоги факторов роста, а также рецепторы или онкобелки-аналоги рецепторов факторов роста. Так происходит, например, при мелкоклеточном раке легкого, клетки которого продуцируют ростовой гормон бомбезин и одновременно рецепторы к нему. При этом происходит и паракринная стимуляция, поскольку бомбезин может взаимодействовать и с соседними клетками.
Яркий пример паракринной стимуляции опухоли - продукция инсулиноподобного фактора роста 2 фибробластами стромы рака легкого. Фактор роста взаимодействует с рецепторами на раковых клетках и стимулирует их пролиферацию. Автономный рост опухоли выражается в утрате контактного торможения и иммортализации (приобретение бессмертия) опухолевых клеток, что может быть объяснено переходом клеток на аутокринный и паракринный пути регулирования своего роста.
Автономность опухоли носит относительный характер, поскольку опухолевая ткань постоянно получает от организма различные питательные вещества, кислород, гормоны, цитокины, приносимые с током крови. Кроме того, она испытывает воздействия иммунной системы и прилежащей окружающей неопухолевой ткани.
Таким образом, автономность опухоли следует понимать не как полную независимость опухолевых клеток от организма, а как приобретение опухолевыми клетками способности к самоуправлению.
В злокачественных опухолях автономный рост выражен значительно, и они растут быстро, прорастая прилежащие нормальные ткани. В доброкачественных опухолях он выражен крайне слабо. Некоторые из них поддаются регуляторным воздействиям, растут медленно, не прорастая в соседние ткани.
Прогрессия опухоли
Теория прогрессии опухолей разработана L. Foulds в 1969 г. на основе данных экспериментальной онкологии. Согласно теории об опухолевой прогрессии, происходит постоянный стадийный прогрессирующий рост опухоли с прохождением ею ряда качественно отличных стадий. Проявляется автономность не только роста, но и всех других признаков опухоли, как полагал сам автор теории.
С последней точкой зрения трудно согласиться, поскольку злокачественность опухоли всегда имеет материальную базу в виде активного синтеза определенных онкопротеинов, факторов роста, их рецепторов. Это обстоятельство откладывает отпечаток на проявления морфологического атипизма опухоли и используется в прогнозировании жизни онкологических больных.
Опухоль постоянно изменяется: происходит прогрессия, как правило, в сторону повышения ее злокачественности, которая проявляеются инвазивным ростом и развитием метастазов.
Стадия инвазивной опухоли характеризуется возникновением инфильтрирующего роста. В опухоли появляются развитая сосудистая сеть и строма, выраженная в различной степени. Границы с прилежащей неопухолевой тканью отсутствуют из-за прорастания в нее опухолевых клеток. Инвазия опухоли протекает в три фазы и обеспечивается определенными генетическими перестройками.
Первая фаза инвазии опухоли характеризуется ослаблением контактов между клетками, о чем свидетельствуют уменьшение количества межклеточных контактов, снижение концентрации некоторых адгезивных молекул из семейства CD44 и других и, наоборот, усиление экспрессии прочих, обеспечивающих мобильность опухолевых клеток и их контакт с экстрацеллюлярным матриксом.
На клеточной поверхности снижается концентрация ионов кальция, что приводит к повышению отрицательного заряда опухолевых клеток. Усиливается экспрессия интегриновых рецепторов, обеспечивающих прикрепление клетки к компонентам экстрацеллюлярного матрикса - ламинину, фибронектину, коллагенам.
Во второй фазе опухолевая клетка секретирует протеолитические ферменты и их активаторы, которые обеспечивают деградацию экстрацеллюлярного матрикса, освобождая тем самым ей путь для инвазии.
В то же время продукты деградации фибронектина и ламинина являются хемоаттрактантами для опухолевых клеток, которые мигрируют в зону деградации в ходе третьей фазы инвазии, а затем процесс повторяется снова.
Стадия метастазирования - заключительная стадия морфогенеза опухоли, сопровождающаяся определенными гено- и фенотипическими перестройками опухоли. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим и кровеносным сосудам, периневрально, имплантационно, что стало основой выделения видов метастазирования.
Процесс метастазирования объясняется теорией метастатического каскада, в соответствии с которой опухолевая клетка претерпевает цепь (каскад) перестроек, обеспечивающих распространение в отдаленные органы.
В процессе метастазирования опухолевая клетка должна обладать определенными качествами:
- проникать в прилежащие ткани и просветы сосудов (мелких вен и лимфатических сосудов);
- отделяться от опухолевого пласта в ток крови (лимфы) в виде отдельных клеток или небольших их групп;
- сохранять жизнеспособность после контакта в токе крови (лимфы) со специфическими и неспецифическими факторами иммунной защиты;
- мигрировать в венулы (лимфатические сосуды) и прикрепляться к их эндотелию в определенных органах;
- инвазировать микрососуды и расти на новом месте в новом окружении.
Метастатический каскад условно может быть разделен на четыре этапа:
- формирование метастатического опухолевого субклона;
инвазия в просвет сосуда; - циркуляция опухолевого эмбола в кровотоке (лимфотоке);
- оседание на новом месте с формированием вторичной опухоли.
Процесс метастазирования начинается с возникновения метастатического субклона опухолевых клеток с измененной плазмолеммой, в результате чего теряются межклеточные контакты и появляется способность к передвижению.
Затем опухолевые клетки мигрируют через экстрацеллюлярный матрикс, прикрепляясь интегриновыми рецепторами к ламинину, фибронектину, коллагеновым молекулам базальной мембраны сосуда, осуществляют ее протеолиз за счет выделения коллагеназ, катепсина, эластазы, гликозаминогидролазы, плазмина и др. Это позволяет опухолевым клеткам инвазировать базальную мембрану сосуда, прикрепляться к его эндотелию, а затем, изменяя свои адгезивные свойства (супрессия адгезивных молекул семейства cell adhesiv molecules - CAM), отделяться как от опухолевого пласта, так и от эндотелия сосуда.
На следующем этапе формируются опухолевые эмболы, которые могут состоять только из опухолевых клеток или же в сочетании с тромбоцитами и лимфоцитами. Фибриновое покрытие таких эмболов может защищать опухолевые клетки от элиминации клетками иммунной системы и действия неспецифических факторов защиты.
На заключительном этапе происходят взаимодействие опухолевых клеток с эндотелием венул за счет -рецепторов и CD44 молекул, прикрепление и протеолиз базальной мембраны, инвазия в периваскулярную ткань и рост вторичной опухоли.
Доброкачественные опухоли характеризуются доминированием опухолевых клеток одного клона на протяжении всего существования, в то время как в злокачественных опухолях постоянно прогрессирует поликлоновость, особенно в низкодифференцированных высокозлокачественных вариантах.
Теория клональной эволюции может помочь в объяснении не только прогрессии злокачественной опухоли и метастазирования, но и дать ответы на такие вопросы:
- почему в опухолях может возникать феномен метаплазии (изменения дифференцировки клеток на отдельных участках);
- как может усиливаться злокачественность опухоли со временем или особенно после противоопухолевой терапии;
- почему возникают устойчивые к противоопухолевым воздействиям новообразования спонтанно и после терапевтических воздействий (феномен множественной лекарственной устойчивости опухоли).
Роль стромы опухоли и процессов ангиогенеза в ее автономном росте и прогрессии
Важный структурный компонент опухоли - ее строма. Строма в опухоли, как и строма в нормальной ткани, в основном выполняет трофическую, модулирующую и опорную функции.
Стромальные элементы опухоли представлены клетками и экстрацеллюлярным матриксом соединительной ткани, сосудами и нервными окончаниями. Экстрацеллюлярный матрикс опухолей представлен двумя структурными компонентами: базальными мембранами и интерстициальным соединительнотканным матриксом.
В состав базальных мембран входят коллагены IV, VI и VII типов, гликопротеиды (ламинин, фибронектин, витронектин), протеогликаны (гепаран сульфат и др.). Интерстициальный соединительнотканный матрикс содержит коллагены I и III типов, фибронектин, протеогликаны и гликозаминогликаны.
Происхождение стромы опухоли. Получены убедительные экспериментальные данные о возникновении клеточных элементов стромы опухолей из предсуществующих нормальных соединительнотканных предшественников окружающей опухоль тканей. В 1971 г.
J. Folkman показал, что клетки злокачественных опухолей продуцируют некий фактор, стимулирующий пролиферацию элементов сосудистой стенки и рост сосудов. Это сложное вещество белковой природы назвали фактором Фолькмана.
Как впоследствии было установлено, фактор Фолькмана представлеяет собой группу факторов роста фибробластов, которых уже известно более 11. Фолькман первым убедительно показал, что стромообразование в опухоли является результатом сложных взаимодействий между опухолевой клеткой и клетками соединительной ткани.
Важную роль в стромообразовании в неоплазме выполняют соединительнотканные клетки как местного, гистиогенного, так и гематогенного происхождения. Стромальные клетки продуцируют разнообразные факторы роста, стимулирующие пролиферацию клеток мезенхимального происхождения (факторы роста фибробластов, фактор роста тромбоцитов, фактор некроза опухоли a, фибронектин, инсулиноподобные факторы роста и др.), некоторые онкобелки (c-sis, c-myc). Одновременно экспрессируют рецепторы, связывающие факторы роста и онкобелки, что позволяет стимулировать их пролиферацию как по аутокринному, так и по паракринному пути.
Кроме того, сами клетки стромы способны выделять разнообразные протеолитические ферменты, приводящие к деградации экстрацеллюлярного матрикса.
Опухолевые клетки активно участвуют в образовании стромы.
Во-первых, трансформированные клетки стимулируют пролиферацию соединительнотканных клеток по паракринному регуляторному механизму, продуцируют факторы роста и онкопротеины.
Во-вторых, они способны стимулировать синтез и секрецию соединительнотканными клетками компонентов экстрацеллюлярного матрикса.
В-третьих, сами опухолевые клетки способны секретировать определенные компоненты экстрацеллюлярного матрикса. Причем тип таких компонентов имеет характерный состав в некоторых опухолях, что можно использовать при их дифференциальной диагностике.
В-четвертых, опухолевые клетки продуцируют ферменты (коллагеназы и др.), их ингибиторы и активаторы, способствующие или, напротив, препятствующие ифильтрирующему и инвазивному росту злокачественных опухолей. Динамическое равновесие между активаторами коллагеназ и их ингибиторами обеспечивает стабильное состояние опухоли и препятствует прорастанию в прилежащие ткани. В момент роста опухолевые клетки активно синтезируют коллагеназы, эластазы и их ингибиторы.
Злокачественые опухоли часто формируют строму, в которой доминирует тип коллагена стромы соответствующего органа на стадии эмбрионального развития. Так, например, в строме рака легкого преобладающим типом коллагена является коллаген III, характерный для эмбрионального легкого.
Разные опухоли могут отличаться по составу коллагенов стромы. В карциномах, как правило, доминируют коллагены III типа (рак легкого), IV типа (почечно-клеточный рак и нефробластомы), в саркомах - интерстициальные коллагены, но в хондросаркоме - коллаген II. В синовиальной саркоме много коллагена IV.
Описанные различия в композиции стромы особенно важно учитывать при дифференциальной диагностике сарком.
Ангиогенез в опухоли. Рост опухолей зависит от степени развитости в них сосудистой сети. В новообразованиях диаметром менее 1-2 мм питательные вещества и кислород поступают из тканевой жидкости окружающих тканей путем диффузии. Для питания же более крупных новообразований необходима васкуляризация их ткани.
Ангиогенез в опухоли обеспечивается группой ангиогенных факторов роста, некоторые из них могут генерироваться также активированными эпителиальными клетками в очагах хронического воспаления и регенерации. В группу ангиогенных факторов опухоли входят факторы роста фибробластов, эндотелия, сосудов глиомы, кератиноцитов, эпидермоидный фактор роста, ангиогенин, некоторые колониестимулирующие костномозговые факторы и др.
Наряду с факторами роста в ангиогенезе имеет большое значение состав экстрацеллюлярного матрикса стромы опухоли. Благоприятным является содержание в нем компонентов базальных мембран - ламинина, фибронектина и коллагена IV типа.
Формирование сосудов в опухолях происходит на фоне извращенной митогенетической стимуляции и измененного экстрацеллюлярного матрикса. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, имеющих нередко прерывистую базальную мембрану и нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетками, а иногда и вовсе отсутствовать.
Роль стромы для опухоли не ограничивается только трофическими и опорными функциями. Строма оказывает модифицирующее воздействие на поведение опухолевых клеток, то есть регуляторно влияет на пролиферацию, дифференцировку опухолевых клеток, возможность инвазивного роста и метастазирования. Модифицирующее влияние стромы на опухоль осуществляется благодаря наличию на клеточных мембранах опухолевых клеток интегриновых рецепторов и адгезивных молекул, способных передавать сигналы на элементы цитоскелета и дальше в ядро опухолевой клетки.
Интегриновые рецепторы - класс гликопротеидов, расположенных трансмембранно, внутренние концы которых связаны с элементами цитоскелета, а наружный, внеклеточный, способен взаимодействовать с трипептидом субстрата Arg-Gly-Asp.
Каждый рецептор состоит из двух субъединиц a и b, имеющих множество разновидностей. Различные сочетания субъединиц обеспечивают разнообразие и специфичность интегриновых рецепторов.
В опухолях интегриновые рецепторы подразделяются на межклеточные и интегриновые рецепторы между опухолевыми клетками и компонентами экстрацеллюлярного матрикса - ламининовые, фибронектиновые, витронектиновые, к различным типам коллагенов, к адгезивным молекулам семейства CD44.
Интегриновые рецепторы обеспечивают межклеточные взаимодействия между опухолевыми клетками, а также с клетками и экстрацеллюлярным матриксом стромы. В конечном итоге они определяют способность опухоли к инвазивному росту и метастазированию.
Адгезивные молекулы САМ - другой важный компонент клеточных мембран опухолевых клеток, обеспечивающий их взаимодействие между собой и со стромальными компонентами. Они представлены семействами NCAM, LCAM, N-кадгерином, CD44.
При опухолевой трансформации изменяются структура и экспрессия адгезивных молекул, входящих в состав клеточных мембран, в результате чего нарушаются взаимосвязи между опухолевыми клетками, а следовательно, начинаются инвазивный рост и метастазирование.
В зависимости от развитости стромы опухоли подразделяются на органоидные и гистиоидные.
В органоидных опухолях имеются паренхима и развитая строма. Пример органоидных опухолей - различные опухоли из эпителия. Степень развитости стромы может также варьировать от узких редких фиброзных прослоек и сосудов капиллярного типа в медуллярном раке до мощных полей фиброзной ткани, в которой эпителиальные опухолевые цепочки едва бывают различимыми, в фиброзном раке или скирре.
В гистиоидных опухолях доминирует паренхима, строма практически отсутствует, так как представлена лишь тонкостенными сосудами капиллярного типа, необходимыми для питания. По гистиоидному типу построены опухоли из собственной соединительной ткани и некоторые другие неоплазмы.
Итак, можно заключить, что образование стромы в опухоли является сложным многостадийным процессом, основными ступенями которого можно считать:
Опухоль представляет собой новообразование, клетки которого утратили способность к контролируемому росту. Данная группа заболеваний является очень обширной, поэтому ее выделяют в отдельный раздел медицины — онкологию. Онкология занимается изучением механизмов развития, диагностикой, лечением, профилактикой не только злокачественных, но и доброкачественных новообразований.
Опухоли представлены в очень большом многообразии и могут развиваться в любом органе или ткани. Для каждого вида новообразования выделяют ряд признаков, по которым проводится классификация и устанавливается диагноз.
Атипизм опухолей
Любая опухоль состоит из стромы и паренхимы. Строма представляет собой внеклеточный матрикс, сосуды и нервные окончания. Паренхима — это непосредственно опухолевые клетки. По своей структуре они, как правило, отличаются от нормальных клеток — это и есть атипизм. Отличие может заключаться не только в строении самих клеток, но и в их функционировании, метаболизме и др. Поэтому выделяют несколько видов атипизма:
- Морфологический атипизм. Может быть клеточным и тканевым. В первом случае клетки опухоли теряют способность к созреванию и дифференцировке, в результате чего они приобретают большое ядро, неправильную форму и другие признаки, которые отличают их от нормальных клеток. При тканевом атипизме изменяется соотношение различных элементов ткани, например, соотношение толщины эпидермиса и дермы.
- Биохимический атипизм. Характеризуется изменением метаболизма опухоли. Именно эта особенность играет важную роль в бесконтрольном росте новообразованной ткани. У опухолевых клеток изменяются практически все виды обмена веществ, но наиболее существенным является изменение обмена углеводов, который увеличивается в несколько десятков раз. Среди других особенностей можно отметить преобладание синтеза белка над его распадом, усиленное поглощение аминокислот и воды, накопление ионов калия и потеря ионов кальция.
- Иммунологический атипизм. Для опухолей характерно изменение антигенной структуры. По этой причине иммунная система не может эффективно «атаковать» измененные клетки, в результате чего последние могут бесконтрольно размножаться и расти.
- Функциональный атипизм. Является следствием описанных выше изменений. Изменение строения и метаболизма клеток опухоли неминуемо приводит к изменению их функций. Это может быть повышенная секреция гормонов, потеря способности к фагоцитозу, выработка веществ, которые в норме не образуются и др.
Некоторые виды атипизма позволили разработать специфические противоопухолевые препараты. В частности, некоторые цитостатики, которые используются во время химиотерапии, блокируют потребление глутамина и глюкозы. Эти вещества используются определенными опухолями в большом количестве и необходимы для роста и деления патологических клеток. Иммунологический атипизм лег в основу иммунотерапии раковых заболеваний. При помощи специальных препаратов удается устранить «защитные механизмы» опухоли, которые делают ее «невидимой» для иммунной системы.
Особенности роста опухолей
Второй важный признак, который характерен для всех новообразований — это бесконтрольный и автономный рост. То есть опухоль может расти столько, сколько существует организм. При этом регулирующие механизмы, которые распространяются на нормальные клетки, не работают. Выделяют следующие разновидности роста:
- Экспансивный рост. Характерен для доброкачественных опухолей. Первичный очаг имеет четкие границы за счет капсулы. При увеличении опухоли в размерах, отмечается оттеснение и сдавливание окружающих тканей.
- Инфильтрирующий рост. Характеризуется врастанием опухоли в окружающие ткани, поэтому его еще называют инвазивным ростом. При этом границы первичного очага стерты, за счет чего возникают сложности с определением точных размеров. Опухоль захватывает не только здоровые ткани органа, но и лимфатические протоки и кровеносные сосуды, что является предпосылкой к метастазированию. Такой вид роста отмечается при злокачественных новообразованиях.
- Экзофитный и эндофитный рост. Отмечается в полых органах. В первом случае опухоль растет в просвет органа, а во втором — в его стенку.
- Уницетрический рост — новообразование развивается из единичного очага, расположенного в одном органе.
- Мультицентрический рост — новообразование исходит из нескольких очагов, расположенных в одном органе.
Для каждого вида опухоли характерны определенные особенности роста. Доброкачественные новообразования в большинстве случаев растут медленно, могут длительное время не увеличиваться в размерах и даже регрессировать. При злокачественных новообразованиях, наоборот, часто отмечается быстрый рост с инфильтрацией и разрушением здоровой ткани.
Разновидности опухолей
Классификация опухолей проводится по различным параметрам. Одним из важнейших является степень дифференцировки. На основании этого признака выделяют доброкачественные и злокачественные новообразования. Доброкачественные опухоли состоят из дифференцированных клеток. Их клетки максимально схожи с клетками нормальных тканей. По этой причине такие заболевания не представляют серьезной угрозы для здоровья в большинстве случаев. Для доброкачественных опухолей характерны следующие признаки:
- Медленный рост.
- Отсутствие метастазов.
- Отсутствие инфильтрации окружающих тканей.
- Отсутствие склонности к рецидивам.
Доброкачественные опухоли очень хорошо поддаются лечению, которое проводится хирургическими методами. Примерами таких новообразований являются миома, липома, аденома, папиллома, атерома.
Злокачественные опухоли состоят из слабодифференцированных клеток, которые утратили свою функцию и приобрели способность к бесконтрольному делению. Они обладают негативным влиянием на организм, прорастают в окружающие ткани, быстро распространяются по организму и приводят к выраженному нарушению работы внутренних органов.
Ключевым отличием злокачественных опухолей от доброкачественных является склонность к метастазированию. Метастаз представляет собой вторичный опухолевый очаг, который возникает в отдаленном органе или ткани в результате перемещения раковых клеток из первичного очага. Для каждого вида рака характерны определенные локализации метастазов. Наиболее часто поражаются печень, легкие, кости, головной мозг. Распространение опухолевых клеток может происходить следующими способами:
- Через кровь (гематогенное метастазирование).
- Через лимфатические протоки (лимфогенное метастазирование).
- По нервным волокнам (периневральное метастазирование).
- При контакте с другими органами и тканями (контактное метастазирование).
В некоторых случаях может отмечаться комбинация из нескольких вариантов.
Среди других особенностей злокачественных опухолей, отмечается склонность к рецидивам, сложности в лечении и существенное влияние на функции организма за счет нарушения обмена веществ. В частности, раковые клетки активно поглощают глюкозу, витамины и другие питательные вещества, нарушают естественные биохимические реакции и выделяют токсины, которые губительны для здоровых клеток. В результате развиваются такие общие симптомы рака, как кахексия (истощение), гипоксия, анемия, интоксикационный синдром.
Почему возникают опухоли
До сих пор ученые не смогли установить точные причины и механизмы образования опухолей, однако благодаря современным молекулярным методам диагностики, известны важные детали процесса онкогенеза. Нарушение процесса деления и дифференцировки клеток развивается в результате изменений в молекулах ДНК. Такой сбой могут провоцировать различные факторы, которые называются канцерогенами. Их разделяют на три основные группы:
- Химические канцерогены. Представлены вредными веществами, которые образуются при сгорании табака, используются на производстве, присутствуют в пище, выделяются во внешнюю среду. В эту группу входит очень большое количество веществ, число которых приближается к 2000. Из этого списка выделяются несколько десятков химических канцерогенов, которые оказывают наиболее существенное влияние на организм и с большой долей вероятности приводят к развитию опухолей.
- Физические канцерогены. К ним относится радиоактивное, рентгеновское и ультрафиолетовое излучение в дозах, которые превышают допустимые значения. Физические канцерогены, так же как и химические, не влияют напрямую на образование опухолевых клеток. Они провоцируют различные изменения, в том числе и нарушение структуры ДНК, которые и становятся причиной развития различных новообразований.
- Биологические канцерогены. Данная группа представлена специфическими вирусами, которые способствуют онкогенезу. В эту группу входят некоторые типы вируса папилломы человека, ретровирусы, аденовирусы, вирусы гепатита В и С и др. Биологические канцерогены, в отличие от двух предыдущих групп, напрямую влияют на генетический аппарат клетки и изменяют его.
Понимание механизмов развития опухолей и открытие различных канцерогенов позволили врачам разработать средства профилактики. В частности, чтобы снизить риск развития доброкачественных и злокачественных новообразований необходимо отказаться от курения, следить за рационом, избегать работы во вредных условиях труда, укреплять иммунитет и др.
Классификация опухолей
Наиболее простой и понятной является классификация доброкачественных новообразований. В этом случае необходимо знать лишь ткань, из которой развилась опухоль. С учетом этой особенности будет сформирован диагноз. Если доброкачественное новообразование развилось из хрящевой ткани, то диагноз будет «хондрома», из железистой ткани — аденома и др.
Деление злокачественных опухолей куда более сложное. Новообразования из эпителиальной ткани называются раком или карциномой (фолликулярный рак, аденокарцинома). Если опухоль развилась из соединительной ткани, то ее относят к саркомам (хондросаркома, миосаркома), из нервной ткани — глиома и т.д.
Следующий показатель, который учитывается при постановке диагноза — это степень дифференцировки клеток. Она оценивается по шкале Grade и включает в себя следующие варианты:
- GX — определить дифференцировку клеток не удается.
- G1 — клетки высоко дифференцированы.
- G2 — клетки умеренно дифференцированы.
- G3 — клетки низко дифференцированы.
- G4 — клетки недифференцированы.
С увеличением балла увеличивается и агрессивность опухоли, а также степень ее злокачественности.
В зависимости от характеристик первичного очага, наличия метастазов в регионарных лимфоузлах и отдаленных органах, злокачественные опухоли классифицируются по международной системе TNM. Буква Т описывает размер и особенности роста первичной опухоли, N обозначает наличие или отсутствие метастазов в близлежащих лимфоузлах, а буква М — метастазы в отдаленных органах. Для каждой буквы присваивается определенный индекс, в результате диагноз может выглядеть следующим образом — Т3N1М0 или Т1N0М0 и т.д.
На основе классификации TNM, злокачественные опухоли разделяются по стадиям. Локализованный первичный очаг, который не выходит за пределы органа и имеет небольшие размеры, соответствует первой стадии. Если опухоль прорастает в прилегающие органы или имеет отдаленные метастазы, то выставляется четвертая стадия.
Методы диагностики
Для современной онкологии продолжает оставаться актуальной проблема своевременного выявления опухолей, в первую очередь — злокачественных. На начальных стадиях новообразования никак не проявляют себя. Первые признаки отмечаются по мере роста опухоли и нарушения функций тех или иных органов. В таких случаях пациенты жалуются на боль, дискомфорт, слабость и другие неспецифические симптомы, которые зависят от точной локализации новообразования.
Если опухоль расположена поверхностно, например, в тканях молочной железы, то она может прощупываться. Эта особенность немного облегчает диагностику, но для того, чтобы понять истинную природу опухоли, необходимо пройти комплексное обследование. Оно включает в себя различные методы визуализации, которые помогают обнаружить первичный очаг: КТ, МРТ, УЗИ, эндоскопию, рентген.

На следующем этапе перед врачом стоит задача определить вид новообразования, степень дифференцировки клеток и другие важные особенности. Ответить на эти вопросы может биопсия — золотой стандарт диагностики опухолей. Как правило, без биопсии в онкологии невозможно поставить точный диагноз и подобрать лечение.
Дополнительно для оценки общего состояния пациента или для определения чувствительности к тому или иному лекарственному препарату назначаются лабораторные и молекулярно-генетические методы исследований. Точная программа диагностики всегда подбирается индивидуально.
Лечение опухолей
Вторая актуальная проблема онкологии — эффективное лечение новообразований. Если доброкачественную опухоль можно удалить хирургическим путем относительно просто, то при злокачественном процессе сделать это удается не всегда. Из-за отсутствия выраженных симптомов, прорастания опухоли в соседние органы и жизненно важные сосуды и склонности к метастазированию, многие пациенты остаются неоперабельными. В таких ситуациях применяется консервативное лечение, в которое входят такие методы, как химиотерапия, лучевая терапия, таргетная терапия, иммунотерапия и др. Однако в этом случае шансы пациента на полное выздоровление снижаются. Если опухоль распространилась за пределы органа, то консервативная терапия в большинстве случаев поможет отсрочить рецидив и увеличить продолжительность жизни пациента.
Максимально эффективное лечение возможно при обнаружении опухоли на самой ранней стадии, после удаления первичного очага хирургическим путем, после чего при некоторых заболеваниях возможно применение методов консервативного лечения.
В настоящее время все силы врачей и ученых брошены на решение двух актуальных проблем. С одной стороны, разрабатываются методы раннего выявления рака, а с другой — новые и эффективные способы лечения.
Согласно новому подходу к лечению онкологических заболеваний, можно длительно сдерживать микроскопические метастазы, погружая раковые клетки в состояние «сна», и предотвратить появление новых опухолевых очагов. Например, недавнее исследование показало, что можно эффективно сдерживать рост метастатических очагов при раке молочной железы.
Когда произносят словосочетание «лечение рака», то, конечно же, имеют в виду, что врачи стремятся полностью уничтожить раковые клетки в теле пациента. Но в ряде случаев это невозможно. Одно из ключевых свойств злокачественных опухолей — способность к метастазированию. Если у пациента уже есть множественные метастазы, удалить их не получится. Даже после того, как наступила ремиссия, в разных органах могут остаться микроскопические очаги. Их нельзя обнаружить с помощью доступных на данный момент методов диагностики, но однажды они могут «проснуться», и произойдет рецидив.
Кроме того, раковые клетки очень быстро мутируют и приспосабливаются, становятся нечувствительными к противоопухолевым препаратам. Последние исследования показывают, что борьба с раком в некоторых случаях становится для врача-онколога и его пациента неравным боем. Когда назначена новая комбинация препаратов, она помогает в течение некоторого времени, а затем рак снова начинает прогрессировать.
Всё это звучит пессимистично, но ситуация не безнадежна.
Современные исследователи все чаще говорят о том, что в некоторых случаях, возможно, не стоит бросать все силы на уничтожение раковых клеток. Их можно оставить в покое и сдерживать, чтобы они больше не размножались. Таким образом, рак можно воспринимать как временно хроническое заболевание, такое же, как артериальная гипертензия, или сахарный диабет. С таким диагнозом вполне можно жить, если пожизненно получать эффективное лечение.
В ходе недавней работы (ее результаты опубликованы в научном журнале Cancer Research) ученые успешно применили существующий препарат, чтобы «усыпить» опухолевые клетки при раке молочной железы и предотвратить появление новых метастазов.
Как ученым удалось «усыпить» раковые клетки?
Ученые использовали фостаматиниб — препарат, который в настоящее время применяется для лечения иммунной тромбоцитопении, аутоиммунного заболевания, характеризующегося снижением уровня тромбоцитов в крови.
Исследования на лабораторных животных показали, что фостаматиниб способен сдержать размножение раковых клеток и предотвратить развитие из микроскопических очагов более крупных опухолей. Ученые проводили эксперименты на крысах, у которых был искусственно вызван рак молочной железы.
При раке молочной железы, даже если лечение завершилось успешно, и у пациента констатировали ремиссию, в организме могут остаться (и чаще всего остаются) микроскопические метастазы. Они могут «проснуться» и начать расти через 10, 20 лет. Зачастую рецидивировавший рак более агрессивен по сравнению с первичным, и его сложнее лечить.
Клинические испытания организовать сложно
Ученые решили использовать фостаматиниб, потому что известно, что этот препарат ингибирует тирозинкиназу селезенки. Этот белок присутствует в раковых клетках в латентных метастазах.
Проводя эксперименты над крысами с раком молочной железы, исследователи обнаружили, что при введении данного препарата микроскопические метастатические очаги не давали начала новым злокачественным опухолям.
Фостаматиниб привлекателен тем, что обладает низким уровнем токсичности и не вызывает серьезных побочных эффектов. Таким образом, онкологические пациенты могли бы принимать его в течение длительного времени. Если тирозинкиназа присутствует и в других злокачественных опухолях, то их тоже можно было бы в течение длительного времени сдерживать.
Однако, с проверкой нового метода лечения в клинических испытаниях на людях пока есть некоторые сложности. В первую очередь это связано с тем, что пациенты в состоянии ремиссии считаются как бы здоровыми. Сложно предсказать, у кого из них и когда в будущем возникнут метастазы. У некоторых из них есть «спящие» раковые клетки, но обнаружить их невозможно. Поэтому пока непонятно, как и на ком проверять новый метод лечения, и каковы будут показания для его назначения.
К сожалению, после ремиссии могут возникать рецидивы. Предотвратить их сложно. Можно лишь снизить риски, если придерживаться здорового образа жизни и соблюдать рекомендации врача. Онкологическому пациенту, который успешно прошел лечение, в дальнейшем важно регулярно являться на осмотры и проходить рекомендуемые обследования. Это помогает вовремя обнаружить рецидив и принять меры.
Механизм ангиогенеза опухоли
• Рост опухоли ограничивается доступностью питательных субстратов и механизмом выведения продуктов жизнедеятельности
• Опухоль может стимулировать рост кровеносных сосудов (ангиогенез), которые, в свою очередь обеспечивают увеличение ее массы
Способность клеток растущей опухоли к пролиферации зависит от ряда факторов, наиболее важным из которых является адекватная система кровоснабжения. Известно, что развивающаяся опухоль, т. н. первичная опухоль, может достигнуть размера лишь 0,2 мм, а затем начинает испытывать затруднения с доступом к питательным компонентам и кислороду; в то же время такой опухоли уже необходимо иметь систему выведения отходов жизнедеятельности и двуокиси углерода. Клетки, испытывающие гипоксию, могут вступить в апоптоз.
Проблем не возникает, если в опухоли развилась сосудистая система. Сосуды решают вопросы, связанные со снабжением опухоли кислородом и питательными компонентами, а также с выведением отходов жизнедеятельности. В отличие от здоровых тканей, патологическая ткань опухоли обычно не развивается вместе с артериально-венозной сетью. Вместо этого опухолевые клетки должны обеспечить рост сосудов de novo за счет примыкающих здоровых тканей.
Процесс образования новых кровеносных сосудов называется нео-ангиогенез или просто ангиогенез. Он начинается, когда клетки опухоли секретируют ростовые факторы, называемые ангиогенными, которые взаимодействуют с эндотелиальными клетками, образующими капилляры в соседних здоровых тканях. В ответ на воздействие ангиогенных факторов эти эндотелиальные клетки начинают пролиферировать и проникают в ткань опухоли, начиная формировать сосудистую сеть, которая в дальнейшем поддерживает рост опухоли.
Очевидно, что в небольшой первичной опухоли клетки в течение многих лет делятся с постоянной скоростью. Несмотря на это, на протяжении этого периода масса опухоли не увеличивается. В отсутствие системы кровоснабжения клетки в такой опухоли погибают с той же скоростью, с какой они образуются. Эта гибель вызывается нехваткой кислорода (аноксия) и отравлением отходами своей жизнедеятельности.
Действительно, такой может быть конечная судьба большинства первичных опухолей, образовавшихся в тканях человека. В течение этого периода равновесия процесс диффузии обеспечивает потребность небольшой опухоли в кислороде и питательных компонентах, используя находящиеся рядом хорошо васкуляризованные ткани.
После нескольких лет такого скромного клеточного деления некоторые клетки в небольшой массе опухоли внезапно приобретают способность стимулировать ангиогенез. Когда это происходит, масса опухоли вступает на путь быстрого роста. Такая быстрая смена характера роста опухоли, которая происходит в ходе многоэтапного опухолевого процесса, называется ангиогенное переключение. Этот процесс представляет собой еще один барьер, который здоровые ткани воздвигают на пути неограниченной экспансии опухолевых клеток.
В некоторых опухолях формирование кровеносных сосудов не происходит в ходе одного отдельного события при многоэтапном развитии опухоли (подобно ангиогенному переключению). Вместо этого в опухоли по мере ее роста происходит прогрессивное образование сосудов.
Процесс управления ангиогенезом включает сложные кооперативные взаимодействия между клетками опухоли и соседними здоровыми клетками, которые попадают в опухоль и начинают взаимодействовать с раковыми клетками. Считается, что наряду с ангиогенными факторами, которые непосредственно высвобождаются раковыми клетками, фибробласты и макрофаги высвобождают другие важные факторы.
Вместе они индуцируют образование сосудистой сети, которая отвечает всем потребностям опухоли и начинает обеспечивать ее практически неограниченным запасом питательных компонентов и кислорода. Также через опухоль могут прорасти лимфатические сосуды, которые служат для удаления отходов ее жизнедеятельности и интерстициальной жидкости. Однако по сравнению с системой кровоснабжения лимфатические сосуды в жизни опухоли играют довольно скромную роль.
В зависимости от плотности сети капилляров опухоли, различают несколько стадий ее развития. Про опухоли с плотной сетью капилляров говорят, что они сильно васкуляризованы; это часто служит причиной болей у раковых больных и указывает на агрессивно растущую популяцию раковых клеток. Наличие сосудов в опухоли создает еще более угрожающую ситуацию. Это говорит о том, что опухоль получила доступ к основным сосудам организма, что облегчило миграцию ее клеток и заселение ими отдаленных органов.
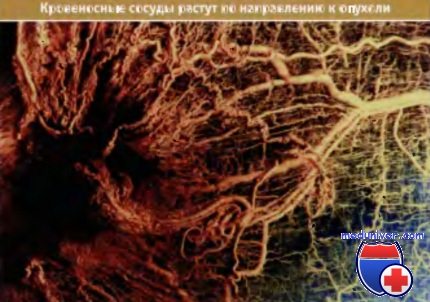
Кровеносные сосуды растут по направлению к опухоли (крысиная саркома мышц).
Сама опухоль находится слева в виде темной области.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также: